题目内容
6.锂水电池以金属锂和钢板为电极材料,LiOH为电解质,使用时加入水即可放电.关于该电池的说法正确的是( )| A. | 钢板是正极,正极上发生还原反应 | |
| B. | 放电时电子的流向:正极→导线→负极 | |
| C. | 放电时OH-向正极移动 | |
| D. | 放电时总反应为:4Li+2H2O+O2=4LiOH |
分析 锂水电池中以金属锂和钢板为电极材料,以LiOH为电解质,Li失电子作负极,水在正极上得电子,放电时,阳离子向正极移动,电池反应式为:2Li+2H2O═2LiOH+H2↑,据此分析解答.
解答 解:A.该原电池中,Li失电子作负极、钢板作正极,正极上得电子发生还原反应,故A正确;
B.放电时,负极上失电子、正极上得电子,所以电子流向为:负极→导线→正极,故B错误;
C.放电时,电解质溶液中氢氧根离子向负极移动、锂离子向正极移动,故C错误;
D.电池反应式为2Li+2H2O═2LiOH+H2↑,故D错误;
故选A.
点评 本题考查化学电源新型电池,为高频考点,明确原电池原理及各个电极上发生的反应是解本题关键,知道电子、离子移动方向,会正确书写电极及电池反应式.

练习册系列答案
相关题目
8.下列实验操作正确的是( )
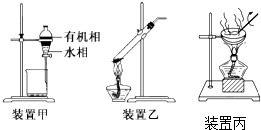

| A. | 用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH | |
| B. | 用装置甲分液,放出水相后再从分液漏斗上口放出有机相 | |
| C. | 用装置乙加热分解NaHCO3固体 | |
| D. | 用装置丙加热硫酸铜溶液获得CuSO45H2O |
17.下列元素中,最高正化合价数值最大的是( )
| A. | Si | B. | N | C. | O | D. | Ar |
1.如表是元素周期表的一部分,针对表中元素,填写下列空白.
(1)Al3+的结构示意图为 .
.
(2)CO2中存在的化学键是共价键,CO2的电子式为 .
.
(3)上述元素中,金属性最强的元素是Na(填元素符号,下同),原子半径最小的元素是F.
(4)F、Cl、S的氢化物中稳定性最弱的是H2S(填化学式,下同).N、P、Si的最高价氧化物对应水化物中酸性最强的是HNO3.
(5)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | Li | Be | B | C | N | O | F |
| 3 | Na | Mg | Al | Si | P | S | Cl |
 .
.(2)CO2中存在的化学键是共价键,CO2的电子式为
 .
.(3)上述元素中,金属性最强的元素是Na(填元素符号,下同),原子半径最小的元素是F.
(4)F、Cl、S的氢化物中稳定性最弱的是H2S(填化学式,下同).N、P、Si的最高价氧化物对应水化物中酸性最强的是HNO3.
(5)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.
11.已知柠檬醛的结构简式为: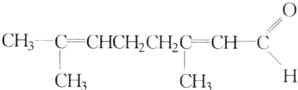 根据已有知识判定下列说法中不正确的是( )
根据已有知识判定下列说法中不正确的是( )
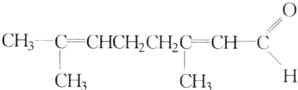 根据已有知识判定下列说法中不正确的是( )
根据已有知识判定下列说法中不正确的是( )| A. | 可使酸性高锰酸钾溶液褪色 | B. | 可跟银氨溶液反应生成银镜 | ||
| C. | 可使溴水褪色 | D. | 催化加氢后最终产物是C10H20O |
16.一定量碳(由12C、13C组成)和足量氧气(由16O组成)反应所得CO2气体,对氢气的相对密度为22.495,则该碳中12C和13C的原子个数比为( )
| A. | 1:99 | B. | 1:100 | C. | 100:1 | D. | 99:1 |
