题目内容
15.第ⅦA族元素具有相似的化学性质,其原因是它们的原子具有相同的( )| A. | 原子半径 | B. | 电子层数 | C. | 最外层电子数 | D. | 核外电子数 |
分析 元素的化学性质取决于该元素原子的最外层电子数,如果元素的最外层电子数相等,则元素具有相似的化学性质.
解答 解:元素的化学性质取决于该元素原子的最外层电子数,第ⅦA族元素具有相似的化学性质,是由于它们的原子具有相同的最外层电子数,故选C.
点评 本题考查元素周期表的结构及应用,学生要掌握原子结构决定元素的性质,决定元素化学性质的是原子最外层电子数.

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
5. 如图为氢氧燃料电池原理示意图,已知该燃料电池总反应为:2H2+O2═2H2O,a极反应为:H2+2OH--2e-═2H2O,下列叙述不正确的是( )
如图为氢氧燃料电池原理示意图,已知该燃料电池总反应为:2H2+O2═2H2O,a极反应为:H2+2OH--2e-═2H2O,下列叙述不正确的是( )
 如图为氢氧燃料电池原理示意图,已知该燃料电池总反应为:2H2+O2═2H2O,a极反应为:H2+2OH--2e-═2H2O,下列叙述不正确的是( )
如图为氢氧燃料电池原理示意图,已知该燃料电池总反应为:2H2+O2═2H2O,a极反应为:H2+2OH--2e-═2H2O,下列叙述不正确的是( )| A. | a电极是负极,发生氧化反应 | |
| B. | b电极的电极反应为4OH--4e-═2H2O+O2↑ | |
| C. | 氢氧燃料电池是一种具有应用前景的绿色电源 | |
| D. | 燃料电池内部H+从负极移向正极 |
3.鉴别①NaOH;②Al2(SO4)3;③Ba(NO3)2;④FeCl3;⑤KCl五种溶液,不用其它试剂,被鉴别出来的顺序是( )
| A. | ①②③④⑤ | B. | ④③①②⑤ | C. | ④①②③⑤ | D. | ②③①④⑤ |
10.电解质在溶液中的行为是化学研究的重要内容.下列有关溶液的叙述正确的是( )
| A. | 常温下 pH为5的盐酸溶液稀释 1000倍后,pH 等于8 | |
| B. | 在滴有酚酞溶液的氨水里,加入盐酸至恰好呈无色,则此时溶液的 pH=7 | |
| C. | 浓度均为0.1 mol/L的氨水和氯化铵溶液,水电离出的 c(H+)前者大于后者 | |
| D. | 等浓度的 CH3COOH与 KOH任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
7.下列说法符合汤姆孙原子结构模型的观点是( )
①任何原子都是电中性的;
②原子像带正电的海洋,电子漂在正电荷的海洋中;
③原子是由带正电的物质和电子构成的;
④阴极射线产生的原因是电子很小,在原子受打击时电子就容易跑出去.
①任何原子都是电中性的;
②原子像带正电的海洋,电子漂在正电荷的海洋中;
③原子是由带正电的物质和电子构成的;
④阴极射线产生的原因是电子很小,在原子受打击时电子就容易跑出去.
| A. | ①②④ | B. | ① | C. | ①②③ | D. | ①②③④ |
4.在氢氧化钾溶液中,已知钾离子与水分子的物质的量之比为a:b,溶液的密度为ρg/cm3,则溶液的浓度为( )
| A. | $\frac{39a}{18b+39a}×100%$ | B. | $\frac{1000ρa}{56a+18b}mol/L$ | ||
| C. | $\frac{a}{56a+18b}mol/L$ | D. | $\frac{56a}{56a+18b}%$ |
5.短周期主族元素X、Y、Z、M、N的原子序数依次增大.X与M的原子核外最外层电子数是周期数的二倍,Y、Z、M最高价氧化物对应的水化物两两之间能相互反应.下列叙述正确的是( )
| A. | 元素非金属性由弱到强的顺序:M、N、Y | |
| B. | 单质Y的熔点高于单质Z的熔点 | |
| C. | 原子最外层电子数由少到多的顺序:Y、Z、X、M、N | |
| D. | 电解N和Z形成的化合物可得到对应的N和Z的单质 |
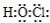 .
.