题目内容
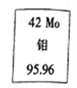
【题目】自然界中氯化钠是由![]() 与
与![]() 和
和![]() 所构成的。已知氯元素的相对原子质量是35.5,则11.7g氯化钠中,含
所构成的。已知氯元素的相对原子质量是35.5,则11.7g氯化钠中,含![]() 的质量为( )
的质量为( )
A. 1.75g B. 1.85g C. 5.25g D. 5.55g
【答案】C
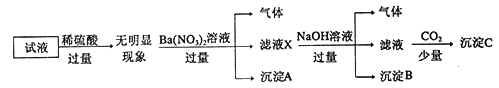
【解析】分析:元素的相对原子质量为该元素各种核素原子的相对原子质量与其在自然界中所占原子个数百分比的乘积之和,原子的相对原子质量在数值上等于其质量数,先根据元素的相对原子质量计算![]() 和
和![]() 的原子个数比,再根据原子个数比计算
的原子个数比,再根据原子个数比计算![]() 的质量。
的质量。
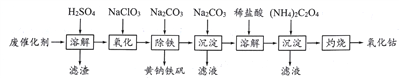
详解:11.7g氯化钠中氯元素的质量=11.7g×35.5/(35.5+23)=7.1g;氯元素的相对原子质量35.5是质量数分别为35和37的核素的平均值,可以采用十字交叉法计算其原子个数比,即![]() ,所以
,所以![]() 和
和![]() 的原子个数之比为0.5:1.5=1:3,因此含
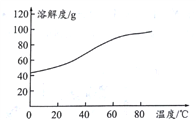
的原子个数之比为0.5:1.5=1:3,因此含![]() 的质量=
的质量= ![]() =5.25g。答案选C。
=5.25g。答案选C。

【题目】如下图所示的装置中,观察到电流计指针偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )
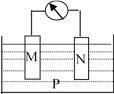
M | N | P | |
A | Zn | Cu | 稀硫酸溶液 |
B | Cu | Fe | 稀盐酸 |
C | Ag | Zn | 硝酸银溶液 |
D | Zn | Fe | 硫酸亚铁溶液 |
A. A B. B C. C D. D
【题目】用中和滴定法测定烧碱的纯度(烧碱中的杂质不和酸反应),请根据实验回答
(1)将称量好的8.8g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除500mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是 .
(2)用式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20molL﹣1的标准盐酸滴定待测液,判断滴定终点的现象是: .
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是(填答案字母序号)
A.c(Na+)>c(Cl﹣)>c(H+)>c(OH﹣)
B.c(Na+)>c(OH﹣)>c(Cl﹣)>c(H+)
C.c(Na+)+c(H+)=c(OH﹣)+c(Cl﹣)
D.c(Cl﹣)+c(Na+)>c(OH﹣)+c(H+)
(5)根据下列数据计算,c(NaOH) mol/L
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.60 | 20.50 |
第二次 | 10.00 | 3.00 | 23.10 |
(6)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面.