��Ŀ����
����Ŀ������ʯ�ͼ�ʽ̼����þ[MgaAlb��OH��c��CO3��dxH2O]�����������ж����ż�Ϊ��Ҫ��Ӧ�ã�ij�о�С���������ʯ��ȡ�������������ʣ��Լ���ʽ̼����þ�����չ���������о���������벢��ɶ��й�����Ľ��
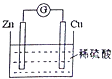
��1������ʯ����ȡ���ʺ�������������Ҫԭ�ϣ�����ʯ����ɺ��������ƣ�����������������������������ʣ�����ʵ�鲽����ͼ1��ʾ�� 
�ٲ���I������Ϊ
�ڻ�Ϸ��ϵ���Ҫ�ɷ�����д��ѧʽ����������Һ�����Ƿ���NH4+�ķ����ǣ�ȡ�ٻ���Һ�����Թ��У������м���������NaOH��Һ�����ȣ������������ܹ�ʹ �� ��֤����Һ���к���NH4+
��һ�������£����������������������Ӧ����������ĸ��
a��KSCN ��Һ b��Al c��NaOH ��Һ
�ܿ����ܹ�Ϊ������Ӧ�ṩ��������д��ѧʽ����
��2����ʽ̼����þ�dz���θҩ����ϲ������Ҫ�ɷ֣�Ϊȷ����ʽ̼����þ����ɣ�����������ʵ�飺
��ȡ��ʽ̼����þ��ĩ6.02g����������2.0molL��1����ʹ���ֻ�Ϸ�Ӧ����Ӧ�����в�����������V�����壩��������������V��HC1���Ĺ�ϵ��ͼ2��ʾ�����ʽ̼����þ����������̼��������ʵ���֮��Ϊ
�ڽ��ٷ�Ӧ��õ��Ļ��Һ�ٺ���������������Һ��ֻ�ϣ���Ӧ��ȫ�����ˡ�ϴ�ӡ�����ó���3.48g�����ʽ̼����þ�Ļ�ѧʽΪ �� 
���𰸡�
��1����ȴ�ᾧ��K2SO4����NH4��2SO4��ʪ��ĺ�ɫʯ����ֽ������b��CO2
��2��16��1��Mg6Al2��OH��16CO3?4H2O
���������⣺��1.������ʯ����Al2O3��Fe2O3�����ʣ���������ϡ��ˮ������ʯ�е��������백ˮ��Ӧ�����˺����I�к�Al2O3��Fe2O3��Al��OH��3 �� ��ҺI�к������ӡ�笠����ӡ���������ӣ���Һ��������Ũ������ȴ�ᾧ�����˵õ�����ء�����茶��壮Al2O3��Fe2O3��Al��OH��3�м����������ƣ�Fe2O3���������Ʋ���Ӧ��Al2O3�������������������Ʒ�Ӧ��Al��OH��3+NaOH�TNaAlO2+2H2O��Al2O3+2NaOH�T2NaAlO2+H2O����Һ�к���NaAlO2��Һ��������Ϊ����������Һ��ͨ�������Ŀ�����������Ӧ��NaAlO2+CO2+2H2O=Al��OH��3��+NaHCO3 �� �ٹ��˵õ�������������Һ���к���NaHCO3 �� �ٲ���I�Ǵ���Һ�л�þ��壬��Ҫ�ṹ����Ũ������ȴ�ᾧ�����˵Ȳ������ʴ�Ϊ����ȴ�ᾧ����������������֪����Ϸ��ϵ���Ҫ�ɷ���K2SO4����NH4��2SO4 �� ������Һ�����Ƿ���NH4+�ķ����ǣ�ȡ�ٻ���Һ�����Թ��У������м���������NaOH��Һ�����ȣ������������ܹ�ʹʪ��ĺ�ɫʯ����ֽ��������֤����Һ���к���NH4+ �� �ʴ�Ϊ��K2SO4����NH4��2SO4��ʪ��ĺ�ɫʯ����ֽ�������۳�����Ϊ��������Al�����������������ȷ�Ӧ����ѡ��b���ܿ����ܹ�Ϊ������Ӧ�ṩ�����ģ�CO2 �� �ʴ�Ϊ��CO2��
��2.���ټ������ᣬ��һ�η�Ӧ����Ϊ��OH��+H+=H2O��CO32��+H+=HCO3������������ķ�Ӧ����Ϊ��HCO3��+H+=CO2��+H2O�����ɶ�����̼�������ᣨ90��85��mL=5mL����n��CO32����=n��HCO3����=0.005L��2mol/L=0.01mol����n��OH����=0.085L��2mol/L��0.01mol=0.16mol�������ʽ̼����þ��n��OH������n��CO32����=0.16mol��0.01mol=16��1���ʴ�Ϊ��16��1���ڼ������������������Һ����Ӧ��ȫ�����ˡ�ϴ�ӡ�����ó���3.48gΪ������þ����������n[Mg��OH��2]= ![]() =0.06mol����ϲ��n��Mg2+��=n[Mg��OH��2]=0.06mol��
=0.06mol����ϲ��n��Mg2+��=n[Mg��OH��2]=0.06mol��
���õ���غ�2n��Mg2+��+3n��Al3+��=n��OH����+2n��CO32��������3n��Al3+��=0.16mol+0.01mol��2��0.06mol��2=0.06mol����n��Al3+��=0.02mol��
�ʣ�m��CO32����=0.01 mol��60 gmol��1=0.6 g
m��OH����=0.16 mol��17 gmol��1=2.72 g
m��Mg2+��=0.06 mol��24 gmol��1=1.44 g
m��Al3+��=0.02 mol��27 gmol��1=0.54 g���ԣ�m��H2O��=6.02g��0.6g��2.72g��1.44g��0.54g=0.72g����n��H2O��= ![]() =0.04 mol��n��Mg2+����n��Al3+����n��OH������n��CO32������n��H2O��=0.02��0.06��0.16��0.01��0.04=6��2��16��1��4����ϲ�����ΪMg6Al2��OH��16CO34H2O���ʴ�Ϊ��Mg6Al2��OH��16CO34H2O��
=0.04 mol��n��Mg2+����n��Al3+����n��OH������n��CO32������n��H2O��=0.02��0.06��0.16��0.01��0.04=6��2��16��1��4����ϲ�����ΪMg6Al2��OH��16CO34H2O���ʴ�Ϊ��Mg6Al2��OH��16CO34H2O��
��1.������ʯ����Al2O3��Fe2O3�����ʣ���������ϡ��ˮ������ʯ�е��������백ˮ��Ӧ�����˺����I�к�Al2O3��Fe2O3��Al��OH��3 �� ��ҺI�к������ӡ�笠����ӡ���������ӣ���Һ��������Ũ������ȴ�ᾧ�����˵õ�����ء�����茶��壮Al2O3��Fe2O3��Al��OH��3�м����������ƣ�Fe2O3���������Ʋ���Ӧ��Al2O3�������������������Ʒ�Ӧ��Al��OH��3+NaOH�TNaAlO2+2H2O��Al2O3+2NaOH�T2NaAlO2+H2O����Һ�к���NaAlO2��Һ��������Ϊ����������Һ��ͨ�������Ŀ�����������Ӧ��NaAlO2+CO2+2H2O=Al��OH��3��+NaHCO3 �� �ٹ��˵õ�������������Һ���к���NaHCO3 ��
��2.���ټ������ᣬ��һ�η�Ӧ����Ϊ��OH��+H+=H2O��CO32��+H+=HCO3������������ķ�Ӧ����Ϊ��HCO3��+H+=CO2��+H2O����������������n��OH������n��CO32�������ڼ������������������Һ����Ӧ��ȫ�����ˡ�ϴ�ӡ�����ó���3.48gΪ������þ������������n= ![]() ����n[Mg��OH��2]����ϲ��n��Mg2+��=n[Mg��OH��2]�����õ���غ�2n��Mg2+��+3n��Al3+��=n��OH����+2n��CO32��������n��Al3+�������ݽ����Ʒ�������ˮ���������ٸ��ݸ���n=
����n[Mg��OH��2]����ϲ��n��Mg2+��=n[Mg��OH��2]�����õ���غ�2n��Mg2+��+3n��Al3+��=n��OH����+2n��CO32��������n��Al3+�������ݽ����Ʒ�������ˮ���������ٸ��ݸ���n= ![]() ����n��H2O�����ݴ�ȷ��n��Mg2����n��Al3+����n��OH������n��CO32������n��H2O�����ݴ���д��ѧʽ��
����n��H2O�����ݴ�ȷ��n��Mg2����n��Al3+����n��OH������n��CO32������n��H2O�����ݴ���д��ѧʽ��

����Ŀ�������±��е���Ϣ�����ش����⣺
Ԫ�� | Ԫ�ػ���Ԫ����ɵ��������� |
A | ��������Ȼ����Ӳ�����ȼ�ղ�����������ʹ����ʯ��ˮ����ǡ� |
B | ԭ�������������Ǵ������������� |
C | ������ɫ��ӦΪ��ɫ��������ȼ�����ɵ���ɫ���� |
D | �����ڿ��������������� |
E | ����Ϊ����ɫ��ȼ�ղ���������Ư���ԡ� |
F | ��ͬ�����������ܶ���С |
��1���õ���ʽд���γ�F2E�Ĺ���__________________��
��2��д��CBF���ʵĵ���ʽ______________��
��3��C2B2�����д��ڻ�ѧ����������___________ ��1 molC2B2������AB2��Ӧת�Ƶĵ�����Ϊ_______��
��4����B��C��E�γɵļ����Ӱ뾶�ɴ�С�Ĺ�ϵ��______________�������ӷ��ű�ʾ����
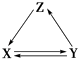
����Ŀ��������и��������У�����֮��ͨ��һ����Ӧ��ʵ����ͼ��ʾת�����ǣ� ��
X | Y | Z | |
�� | Cu | CuO | Cu��OH��2 |
�� | CH3CH2OH | CH3CHO | CH2�TCH2 |
�� | Na2CO3 | NaOH | NaHCO3 |
�� | CaCO3 | CaO | Ca��OH��2 |
A.�ڢ�
B.�ۢ�
C.�ڢ�
D.�٢�