题目内容
 现有原子序数依次增大的A、B、C、D、E、F、G七种前36号元素.已知A、B组成的10个电子4核分子X,能使湿润的红色石蕊试纸变蓝,A、B还能组成18个电子6核分子Y;C原子的最外层电子书是次外层电子书的3倍;D、E、F三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水;G原子核电子排布中未成对电子数在前36号元素原子钟最多.
现有原子序数依次增大的A、B、C、D、E、F、G七种前36号元素.已知A、B组成的10个电子4核分子X,能使湿润的红色石蕊试纸变蓝,A、B还能组成18个电子6核分子Y;C原子的最外层电子书是次外层电子书的3倍;D、E、F三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水;G原子核电子排布中未成对电子数在前36号元素原子钟最多.请回答下列问题:
(1)G的基态原子价电子排布式为
(2)X分子的空间构型为
(3)D、E最高价氧化物的水化物之间反应生成盐M,E、F最高价氧化物的水化物之间反应生成盐N,M溶液与N溶液之间反应的离子方程式
(4)用高能射线照射液态A2C时,一个A2C分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,试写出离子的电子式
考点:位置结构性质的相互关系应用
专题:
分析:现有原子序数依次增大的A、B、C、D、E、F、G七种前36号元素.已知A、B组成的10个电子4核分子X,能使湿润的红色石蕊试纸变蓝,则X为NH3,A、B还能组成18个电子6核分子Y,则Y为N2H4,所以A为H元素,B为N元素,C原子的最外层电子书是次外层电子书的3倍,则C为O元素;D、E、F三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水,则三种元素的最高价氧化物的水化物其中一种为强碱、一种为强酸、另一种为两性氢氧化物,D、E最高价氧化物的水化物之间反应生成盐M,E、F最高价氧化物的水化物之间反应生成盐N,则E为Al元素,D的原子序数比E小,则D为Na,所以F的最外层电子数为10-3-1=4,则F为S元素;G原子核电子排布中未成对电子数在前36号元素原子钟最多,则G的外围电子排布式为3d54s1,所以G为Cr元素;据此结合元素及其化合物的性质分析解答.
解答:
解:现有原子序数依次增大的A、B、C、D、E、F、G七种前36号元素.已知A、B组成的10个电子4核分子X,能使湿润的红色石蕊试纸变蓝,则X为NH3,A、B还能组成18个电子6核分子Y,则Y为N2H4,所以A为H元素,B为N元素,C原子的最外层电子书是次外层电子书的3倍,则C为O元素;D、E、F三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水,则三种元素的最高价氧化物的水化物其中一种为强碱、一种为强酸、另一种为两性氢氧化物,D、E最高价氧化物的水化物之间反应生成盐M,E、F最高价氧化物的水化物之间反应生成盐N,则E为Al元素,D的原子序数比E小,则D为Na,所以F的最外层电子数为10-3-1=4,则F为S元素;G原子核电子排布中未成对电子数在前36号元素原子钟最多,则G的外围电子排布式为3d54s1,所以G为Cr元素;
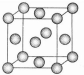
(1)G为Cr元素,其基态原子价电子排布式为3d54s1;由晶胞图可知该晶胞为面心立方最密堆积,其配位数为12;
故答案为:3d54s1;12;
(2)X为NH3,其空间构型为三角锥形,中心原子N原子有3个成键电子对和1个孤电子对,则为sp3杂化;氮气含有2个原子,价电子数为10,与CO互为等电子体;
故答案为:三角锥形;sp3;CO;
(3)Na、Al最高价氧化物的水化物之间反应生成盐NaAlO2,Al、S最高价氧化物的水化物之间反应生成盐Al2(SO4)3,NaAlO2溶液与Al2(SO4)3溶液之间反应生成氢氧化铝沉淀,其反应的离子方程式为:Al3-+3AlO2-+6H2O=4Al(OH)3↓;
故答案为:Al3-+3AlO2-+6H2O=4Al(OH)3↓;
(4)A为H元素,C为O元素,A2C为H2O分子,用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,失去一个电子后得到的阳离子含有9个电子为H2O+,该阳离子中O与H之间形成1对共用电子对,其电子式为: ;该阳离子与F氢化物的水溶液反应生成一种黄色固体,则黄色固体为S,H2O+与H2S发生氧化还原反应生成S、水与H+,其反应的离子方程式为:2H2O++H2O=S↓+2H2O+2H+;
;该阳离子与F氢化物的水溶液反应生成一种黄色固体,则黄色固体为S,H2O+与H2S发生氧化还原反应生成S、水与H+,其反应的离子方程式为:2H2O++H2O=S↓+2H2O+2H+;
故答案为: ;2H2O++H2O=S↓+2H2O+2H+.
;2H2O++H2O=S↓+2H2O+2H+.
(1)G为Cr元素,其基态原子价电子排布式为3d54s1;由晶胞图可知该晶胞为面心立方最密堆积,其配位数为12;
故答案为:3d54s1;12;
(2)X为NH3,其空间构型为三角锥形,中心原子N原子有3个成键电子对和1个孤电子对,则为sp3杂化;氮气含有2个原子,价电子数为10,与CO互为等电子体;
故答案为:三角锥形;sp3;CO;
(3)Na、Al最高价氧化物的水化物之间反应生成盐NaAlO2,Al、S最高价氧化物的水化物之间反应生成盐Al2(SO4)3,NaAlO2溶液与Al2(SO4)3溶液之间反应生成氢氧化铝沉淀,其反应的离子方程式为:Al3-+3AlO2-+6H2O=4Al(OH)3↓;
故答案为:Al3-+3AlO2-+6H2O=4Al(OH)3↓;
(4)A为H元素,C为O元素,A2C为H2O分子,用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,失去一个电子后得到的阳离子含有9个电子为H2O+,该阳离子中O与H之间形成1对共用电子对,其电子式为:
 ;该阳离子与F氢化物的水溶液反应生成一种黄色固体,则黄色固体为S,H2O+与H2S发生氧化还原反应生成S、水与H+,其反应的离子方程式为:2H2O++H2O=S↓+2H2O+2H+;
;该阳离子与F氢化物的水溶液反应生成一种黄色固体,则黄色固体为S,H2O+与H2S发生氧化还原反应生成S、水与H+,其反应的离子方程式为:2H2O++H2O=S↓+2H2O+2H+;故答案为:
 ;2H2O++H2O=S↓+2H2O+2H+.
;2H2O++H2O=S↓+2H2O+2H+.
点评:本题考查了元素周期表和元素周期律的综合应用,涉及元素的推断、电子排布式、杂化类型、离子方程式、电子式等,题目难度中等,根据原子结构和元素的性质推断出具体的元素是解题的关键.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列离子方程式中,正确的是( )
| A、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、硫酸溶液中加入Ba(OH)2溶液:SO42-+Ba2+=BaSO4↓ |
| C、用稀硫酸洗去铁锈:Fe2O3+6H+=2Fe3++3H2O |
| D、将铝片插入硝酸铜溶液中:Cu2++Al=Al3++Cu |
下列是某学生自己总结出的一些规律,其中正确的是( )
| A、化合物都是不同元素组成的,不同元素组成的物质一定是化合物 |
| B、有的化学反应不属于化合、分解、置换、复分解反应中的任何一种 |
| C、一种元素可能有多种氧化物,但同种价态只能对应一种氧化物 |
| D、饱和溶液浓度一定比不饱和溶液的浓度大 |