题目内容
6.如表为元素周期表的一部分,其中Q、X、Y、Z、W为短周期元素,Z元素原子的核电荷数为X元素的2倍.下列说法正确的是( )| Q | X | ||
| Y | Z | W | |
| T |
| A. | X、Z、Y元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、W元素在自然界中均能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | Q与氢元素形成的化合物中不存在非极性共价键 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,最高价氧化物对应水化物的化学式是H3TO4 |
分析 Q、X、Y、Z、W为短周期元素,由元素周期表可知:X应位于第二周期,且应处于周期表中右半部分,Z与X处于同一主族,且Z元素原子的核电荷数为X元素的2倍,那么X为O,Z为S,结合位置可知,Q为C,Y为P,T为As,W为Cl,以此来解答.
解答 解:Q、X、Y、Z、W为短周期元素,由元素周期表可知:X应位于第二周期,且应处于周期表中右半部分,Z与X处于同一主族,且Z元素原子的核电荷数为X元素的2倍,那么X为O,Z为S,结合位置可知,Q为C,Y为P,T为As,W为Cl,
A.原子半径X、Z、Y递增,但气态氢化物的热稳定性Y、Z、X递增,故A错误;
B.非金属性越强,最高价氧化物的水化物的酸性越强,则Y、Z、W递增,但Cl主要以化合物存在,故B错误;
C.Q与氢元素形成的化合物如乙烷,存在C-C非极性键,故C错误;
D.根据元素周期律,As位于金属与非金属交界处,可以推测T元素的单质具有半导体特性,最高价为+5价最高价氧化物对应水化物的化学式是H3TO4,故D正确;
故选D.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.实验室进行下列实验时,一定不需要使用“沸石”的是( )
| A. | 制乙酸丁酯 | B. | 分馏石油 | C. | 制取乙烯 | D. | 溴乙烷的水解 |
17.下列实验“操作”“现象”与“结论”都正确的是( )
| 1 | 操作 | 现象 | 结 论 |
| A | 向白色AgCl悬浊液中滴加0.1mol/LKI溶液 | 试管中白色沉淀转化为黄色沉淀. | Ksp(AgCl)>Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4 | 溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 向Na2SiO3溶液中滴加盐酸 | 溶液变浑浊 | 非金属性:Cl>Si |
| D | SO2通入足量的稀Fe(NO3)3溶液 | 溶液由棕黄色变为浅绿色,后立即又变成棕黄色 | 氧化性:HNO3>H2SO4>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
14.NA为阿伏加德罗常数,下列叙述错误的是( )
| A. | 18 g H2O中含有的质子数为10NA | |
| B. | 12 g C60中含有的碳原子数为60NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
1.为防止NO2污染空气,科学家寻求合适的化合物G和催化剂,以实现反应:NO2+G $\stackrel{催化剂}{?}$N2+H2O+nZ (未配平,n可以为0),上述反应式中的G不可能是( )
| A. | CO | B. | NH3 | C. | H2O2 | D. | CH3CH2OH |
18.乙基香草醛是食品添加剂的增香原料,它的香味浓郁,其结构简式为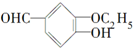 ,下列对该物质叙述正确的是( )
,下列对该物质叙述正确的是( )
 ,下列对该物质叙述正确的是( )
,下列对该物质叙述正确的是( )| A. | 该物质可以进行消去反应 | |
| B. | 该物质可以进行水解反应 | |
| C. | 1 mol该物质最多可与3 mol H2反应 | |
| D. | 该物质可以和Br2进行取代反应 |
1. 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
2.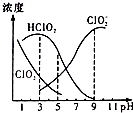 织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出),下列说法错误的是 ( )( )
织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出),下列说法错误的是 ( )( )
 织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出),下列说法错误的是 ( )( )
织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出),下列说法错误的是 ( )( )| A. | 25℃时,HClO2的电离平衡常数的数值Ka=10-6 | |
| B. | 使用该漂白剂的最佳pH为3.0 | |
| C. | 25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) | |
| D. | 该温度下NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+) |