题目内容
14.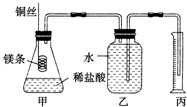 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:该实验的主要操作步骤如下:
①配制100mL 1.0mol•L-1的盐酸溶液;
②用10Ml量筒(填仪器名称并注明规格)量取10.0mL 1.0mol•L-1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为0.12;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读取量筒中水的体积为V mL.
请将上述步骤补充完整并回答下列问题.
(1)用文字表述实验步骤④中检查装置气密性的方法:两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好.
(2)实验步骤⑤中应选用B(填序号)的量筒.
A.100mL B.200mL C.500mL
读数时除恢复到室温外,还要注意①量筒内液面与集气瓶内液面相平;②读数时,视线与量筒刻度以及凹液面最低处在同一水平面上.
(3)若未除去镁条表面的氧化膜,则测量结果偏小(填“偏大”“偏小”或“无影响”).
分析 ②量取溶液的最小读数为0.1mL,可以用10mL量筒量取;
③根据n=cV计算出盐酸中含有HCl的物质的量,再根据反应生成氯化镁计算出消耗镁的物质的量,最后根据m=nM计算出最小质量;
(1)两手掌紧贴锥形瓶外壁,根据广口瓶中长导管内是否有一段水柱高出液面判断装置气密性;
(2)读数时要保持左右气体压强相等,以减少误差,故应将量筒缓缓向下移动,使乙、丙中液面相平;
(3)若未除去镁条表面的氧化膜,导致镁的质量偏小,生成气体体积偏小.
解答 解:②量取10.0mL 1.0mol•L-1的盐酸,需要用10mL量筒量取,
故答案为:10mL量筒;
③10.0mL 1.0mol•L-1的盐酸溶液中含有HCl的物质的量为:1.0mol/L×0.01L=0.01mol,根据反应Mg+2HCl═MgCl2+H2↑可知最少消耗Mg的物质的量为0.005mol,质量为:24g/mol×0.005mol=0.12g,则a至少为0.12,
故答案为:0.12;
(1)检查装置气密性的方法为:两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好,
故答案为:两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好;
(2)10.0mL 1.0mol•L-1的盐酸溶液中含有HCl的物质的量为0.01mol,根据根据反应Mg+2HCl═MgCl2+H2↑可知生成氢气的物质的量为0.005mol,标准状况下0.005mol氢气的体积为:22.4L/mol×0.05mol=112mL,应该用200mL量筒;
读数时要保持左右气体压强相等,以减少误差,故应注意:将量筒缓缓向下移动,;①量筒内液面与集气瓶内液面相平;②读数时,视线与量筒刻度以及凹液面最低处在同一水平面上,
故答案为:B;①量筒内液面与集气瓶内液面相平;②读数时,视线与量筒刻度以及凹液面最低处在同一水平面上;
(3)若未除去镁条表面的氧化膜,生成的氢气体积减少,导致测量的气体摩尔体积偏低,
故答案为:偏小.
点评 本题主要考查实验装置的综合应用,题目难度中等,气体摩尔体积的计算要抓住定义进行计算即可,试题的综合性较强,充分考查了学生的分析能力及化学实验能力.

| A. | 过量的NaHSO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | NaHCO3和过量NaOH溶液相混合:HCO3-+OH-═CO32-+H2O | |
| C. | NaHSO4溶液中滴加NaHCO3溶液:H++HCO3-═H2O+CO2↑ | |
| D. | 用NaOH吸收过量的CO2:CO2+OH-═HCO3- |
| A. | 用FeCl3溶液腐蚀铜线路板:Fe3++3Cu═Fe2++3Cu2+ | |
| B. | 少量氨气中通入过量亚硫酸溶液中:NH3+H2SO3═NH4++HSO3- | |
| C. | Cl2与水反应生成盐酸和次氯酸:Cl2+H2O═H++Cl-+HClO | |
| D. | 小苏打溶液中加入过量的烧碱溶液:HCO3-+OH-═CO32-+H2O |
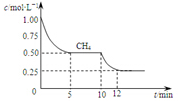 已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol
已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol②CH4(g)+CO2(g)?2CO(g)+2H2(g);△H=+247.3kJ/mol
③CH4(g)+H2O(g)?3H2(g)+CO(g);△H3
若反应③在1升容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示.下列有关叙述错误的是( )
| A. | △H3=+206kJ/mol | |
| B. | 反应③进行到10min时,改变的外界条件可能是升高温度 | |
| C. | 反应③进行过程中,0~5min这段时间共吸收的热量为103.05kJ | |
| D. | 当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大 |

| A. | 该电池工作时电能转变为化学能 | B. | 铁片的质量变轻 | ||
| C. | 铜片上发生的反应2H++2e-=H2↑ | D. | SO42-向铁片移动 |
①热稳定性:H2O>HF>H2S ②结合质子能力:OH->CH3COO->Cl-
③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>O( )
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
| A. | 已溶解的溶质和未溶解的溶质质量相等 | |
| B. | 溶质不再溶解,因此从表面看溶质不再减少,也不再增加 | |
| C. | 升高温度,饱和溶液将变为不饱和溶液 | |
| D. | 溶质的溶解和结晶继续进行,且速率相等 |

 ,名称是苯乙炔;
,名称是苯乙炔;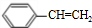 +Br2→
+Br2→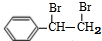 ;
;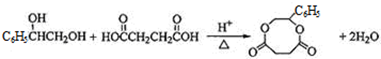 ;
; .
.