题目内容
11.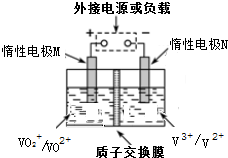 全钒液流储能电池是以溶解于一定浓度硫酸溶液中不同价态钒离子的氧化还原反应来实现化学能和电能相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )
全钒液流储能电池是以溶解于一定浓度硫酸溶液中不同价态钒离子的氧化还原反应来实现化学能和电能相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )| A. | 放电过程中,M电极反应为V02++2H++e一=V02++H20 | |
| B. | 放电过程中,质子通过交换膜从负极区移向正极区 | |
| C. | 充电过程中,N电极上V3+被还原为V2+ | |
| D. | 充电过程中,M电极附近酸性减弱 |
分析 充电时,左槽发生的反应为VO2++H2O═VO2++2H++e-,放电时正极上反应式:VO2++2H++e-═VO2++H2O,充电时,阴极上发生得电子的还原反应,即V3++e-═V2+,放电池负极发生V2+-e-═V3+,以此解答该题.
解答 解:A.放电时M为正极,反应式:VO2++2H++e-═VO2++H2O,故A正确;
B.放电过程中,阳离子向正极移动,即由负极区向正极区移动,故B正确;
C.充电时,阴极上发生得电子的还原反应,即V3++e-═V2+,故C正确;
D.充电时,左槽发生的反应为VO2++H2O═VO2++2H++e-,酸性增强,故D错误;
故选D.
点评 本题考查了化学电源新型电池,为高频考点,根据充放电时各个电极上得失电子来分析解答,难点是电极反应式的书写,要根据电解质溶液酸碱性书写,难度中等.

练习册系列答案
相关题目
1.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子数的3倍,Z是同周期中金属性最强的元素,W与X同主族.下列说法正确的是( )
| A. | 原子半径:X>Y>Z | |
| B. | 阴离子的还原性:W>X>Y | |
| C. | 气态氢化物的沸点:Y<W | |
| D. | 元素X与Z形成的两种化合物中,X的化合价相同 |
16.下列叙述中,正确的是( )
| A. | 能使溴水褪色的物质一定能和溴水发生加成反应 | |
| B. | 天然蛋白质水解的最终产物是多种α-氨基酸 | |
| C. | 能发生银镜反应的物质都是醛 | |
| D. | 棉花和蚕丝的主要成分都是蛋白质 |
3.化学与环境、生活、生产、能源关系密切,下列说法正确的是( )
| A. | 金属铝在生产、生活中得到广泛的应用,主要是因为其可用热还原法冶炼 | |
| B. | 对“地沟油”蒸馏可以获得汽油 | |
| C. | 氯气常用于自来水的消毒,是利用了氯气的强氧化性来杀菌消毒 | |
| D. | 化石燃料使用过程中排放的硫、氮的氧化物是形成酸雨的主要原因 |
20.一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物),则下列叙述正确的是( )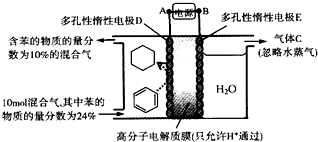

| A. | 多孔性惰性电极E为电解池的阴极 | |
| B. | 装置中气体C为氢气 | |
| C. | 由A至D,导线中电子转移方向为D→A | |
| D. | 装置中阴极的电极反应式为C6H6+6H++6e-═C6H12 |
1.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料为原料生产NiCl2,继而生产Ni2O3的工艺流程如图1:
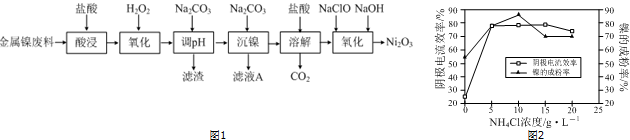
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末等)等.
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是氯化钠.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为10g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是氯化钠.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为10g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
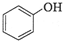
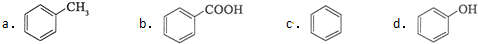
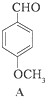 $→_{H+}^{KMnO_{4}}$[B]$→_{浓硫酸,△}^{CH_{3}OH}$
$→_{H+}^{KMnO_{4}}$[B]$→_{浓硫酸,△}^{CH_{3}OH}$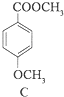
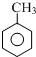 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$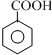
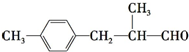
 .
.

 .
.