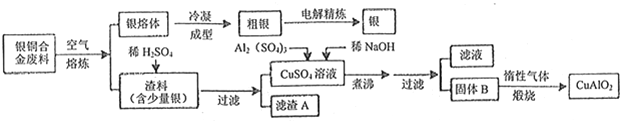
题目内容
1.完成下列问题:(1)体积相同,浓度均为0.2mol/L的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为m<n.
(2)体积相同,浓度均为0.2mol/L的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为m>n.
(3)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为m>n.
分析 (1)体积相同,浓度相同的盐酸和醋酸稀释相同倍数后,比较pH值的大小也就是比较溶液中[H+]的大小;
(2)醋酸为弱电解质,不能完全电离,若稀释后溶液pH相等,则盐酸稀释体积大于醋酸;
(3)一水合氨为弱电解质,溶液中部分电离,稀释后氨水中氢氧根离子的物质的量增大,氢氧化钠溶液中氢氧根离子的物质的量不变,据此分析.
解答 解:(1)HCl、CH3COOH都是一元酸,但HCl是强酸,醋酸是弱酸,HCl完全电离,醋酸只能部分电离,所以相同浓度的盐酸和醋酸稀释相同倍数后盐酸中[H+]高于醋酸中[H+],所以m<n;故答案为:m<n;
(2)醋酸为弱电解质,不能完全电离,若浓度均为0.2mol•L-1、等体积的盐酸和CH3COOH溶液分别加水稀释m倍、n倍,溶液的pH相同,即溶液中氢离子浓度相等,则盐酸稀释的倍数大于醋酸,即m>n,故答案为:m>n;
(3)一水合氨为弱电解质,溶液中部分电离出氢氧根离子,稀释后一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,稀释相同的倍数后,氨水的pH大于氢氧化钠溶液的,分别加水稀释m倍、n倍,溶液的pH都变成9,所以氨水稀释的倍数大,故答案为:m>n.
点评 本题考查了一元弱酸与一元强酸的比较,注意题中所给出的条件是等pH值还是等体积,比较的是溶液中的氢离子浓度还是酸的物质的量.

练习册系列答案
相关题目
16.关于胶体和溶液的叙述中正确的是( )
| A. | 胶体与溶液的本质区别是能否发生丁达尔效应 | |
| B. | 胶体加入某些盐可产生沉淀,而溶液不能 | |
| C. | 胶体是一种介稳性的分散系,而溶液是一种非常稳定的分散系 | |
| D. | 胶体能够发生丁达尔现象,溶液也能发生丁达尔现象 |
6.下列说法正确的是( )
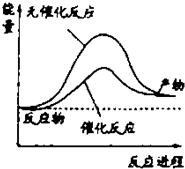

| A. | 如图可表示水分解过程中的能量变化 | |
| B. | 若2C(s)+O2(g)=2CO(g)△=-221.0kJ/mol,则碳的燃烧热为110.5kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知I:反应H2(g)+Cl2(g)=2HCl(g)△=-akJ/mol II:  且a、b、c均大于零,则断开1mol H-Cl键所需的能量为(-a-b-c)kJ/mol |
13.分枝酸可用于生化研究,其结构简式如图所示.下列关于分枝酸的叙述正确的是( )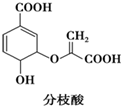

| A. | 分子中含有2种官能团 | |
| B. | 可与乙醇、乙酸反应,且反应类型相同 | |
| C. | 1 mol分枝酸分子中含2mol-OH(羟基) | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
11.2015年底联合国气候变化大会在巴黎召开,签署了《巴黎协定》.该协定要求各国采取更有效的“节能减排”措施控制温室效应.下列做法不利于“节能减排”的是( )
| A. | 减少使用化石燃料 | |
| B. | 大力发展火力发电 | |
| C. | 改变能源结构,开发使用清洁能源 | |
| D. | 将煤气化或液化,以提高其综合利用率 |
 如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间.
如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间.