题目内容
在一定量的水中加入19.0g MgCl2充分溶解并冷却后,该溶液体积为500.0ml,试求:
①该溶液中阴、阳离子的总物质的量
②该溶液中MgCl2的物质的量浓度
③取出20.0ml该溶液,配成浓度为0.01mol/L的稀溶液,则稀释后溶液的体积是多少?
①该溶液中阴、阳离子的总物质的量
②该溶液中MgCl2的物质的量浓度
③取出20.0ml该溶液,配成浓度为0.01mol/L的稀溶液,则稀释后溶液的体积是多少?
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:①根据n=
计算出氯化镁的物质的量,再根据质量守恒计算出该溶液中阴、阳离子的总物质的量;
②根据c=
计算出该溶液中MgCl2的物质的量浓度;
③根据溶液稀释过程中溶质的物质的量不变 计算出稀释后溶液的体积.
| m |
| M |
②根据c=
| n |
| V |
③根据溶液稀释过程中溶质的物质的量不变 计算出稀释后溶液的体积.
解答:
解:①19.0g MgCl2的物质的量为:
=0.2mol,0.1mol氯化镁中含有0.2mol氯化镁中含有0.2mol镁离子、0.4mol氯离子,总共含有0.6mol阴阳离子,根据质量守恒定律,溶液中含有阴阳离子的总物质的量为0.6mol,
答:溶液中阴、阳离子的总物质的量为0.6mol;
②19.0g MgCl2充分溶解并冷却后,该溶液体积为500.0ml,则溶液中氯化镁的物质的量浓度为:c(MgCl2)=
=0.4mol/L,
答:该溶液中MgCl2的物质的量浓度为0.4 mol/L;
③取出20.0ml该溶液,配成浓度为0.01mol/L的稀溶液,稀释过程中溶质的物质的量不变,则稀释后溶液的体积为:
=0.8L=800mL,
答:稀释后溶液的体积是800.0 mL.
| 19.0g |
| 95g/mol |
答:溶液中阴、阳离子的总物质的量为0.6mol;
②19.0g MgCl2充分溶解并冷却后,该溶液体积为500.0ml,则溶液中氯化镁的物质的量浓度为:c(MgCl2)=
| 0.2mol |
| 0.5L |
答:该溶液中MgCl2的物质的量浓度为0.4 mol/L;
③取出20.0ml该溶液,配成浓度为0.01mol/L的稀溶液,稀释过程中溶质的物质的量不变,则稀释后溶液的体积为:
| 0.4mol/L×0.02L |
| 0.01mol/L |
答:稀释后溶液的体积是800.0 mL.
点评:本题考查了物质的量浓度计算,题目难度不大,注意掌握物质的量与物质的量浓度、摩尔质量之间的转化关系,明确物质的量浓度的概念及计算方法.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
短周期元素X、Y、Z和W的原子序数依次增大.X原子的最外层电子数是内层电子数的2倍,Y与X同主族,Z和W原子中未成对电子数之比为2:1.下列说法错误的是( )
| A、XW4为非极性分子 |
| B、Y、Z、W的最高价氧化物的水化物酸性强弱顺序是Y<Z<W |
| C、X、Y的最高价氧化物的空间结构相同 |
| D、XW4、YW4、ZW2分子中的中心原子均为sp3杂化 |
已知:C(s,金刚石)=C(s,石墨)△H=-1.9KJ/mol
C(s,金刚石)+O2(g)=CO2(g)△H1
C(s,石墨)+O2(g)=CO2(g)△H2
根据已述反应所得出的结论正确的是( )
C(s,金刚石)+O2(g)=CO2(g)△H1
C(s,石墨)+O2(g)=CO2(g)△H2
根据已述反应所得出的结论正确的是( )
| A、△H1=△H2 |
| B、△H1>△H2 |
| C、△H1<△H2 |
| D、金刚石比石墨稳定 |
向溶液X中持续通人气体Y,会产生“澄清一浑浊一澄清”现象的是( )
| A、X:漂白粉溶液 Y:二氧化硫 |
| B、X:硝酸钡溶液 Y:二氧化硫 |
| C、X:氯化铝溶液 Y:氨气 |
| D、X:偏铝酸钠溶液 Y:二氧化氮 |
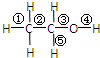 乙醇是一种无色、有特殊香味的液体,是一种重要的有机溶剂和化工原料.其结构如图.其中①②③④⑤表示甲基的C-H键、C-C键、C-O键、O-H键和亚甲基的C-H键.
乙醇是一种无色、有特殊香味的液体,是一种重要的有机溶剂和化工原料.其结构如图.其中①②③④⑤表示甲基的C-H键、C-C键、C-O键、O-H键和亚甲基的C-H键.