题目内容
如图是某水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种粒子平衡时的组成百分率,下列叙述不正确的是( )


| A、此图可完全根据1.0 mol/L盐酸滴定1.0 mol/L碳酸钠溶液的实验数据绘出 |
| B、H2CO3和CO32-在溶液中不能大量共存 |
| C、将1.0 mol/L盐酸加入到等体积1.0 mol/L碳酸钠溶液中,充分反应后溶液呈碱性 |
| D、在pH为6.37时,溶液中:c(H2CO3)=c(HCO3-),在pH为10.25时,溶液中:c(CO32-)=c(HCO3-) |
考点:酸碱混合时的定性判断及有关ph的计算,离子浓度大小的比较
专题:
分析:A、用1.0 mol/L盐酸滴定1.0 mol/L碳酸钠溶液时,先发生:CO32-+H+=HCO3-,后发生:HCO3-+H+=H2O+CO2↑,H2CO3浓度应逐渐增大,且起始浓度不可能为1.0mol/L,据此分析;
B、酸性条件下,能存在大量碳酸,碱性条件下,能存在大量碳酸根离子;
C、碳酸氢钠溶液呈碱性;
D.根据图象判断微粒浓度关系.
B、酸性条件下,能存在大量碳酸,碱性条件下,能存在大量碳酸根离子;
C、碳酸氢钠溶液呈碱性;
D.根据图象判断微粒浓度关系.
解答:
解:A、用1.0 mol/L盐酸滴定1.0 mol/L碳酸钠溶液时,先发生:CO32-+H+=HCO3-,CO32-的浓度减小,HCO3-的浓度增大;后发生:HCO3-+H+=H2O+CO2↑,HCO3-的浓度减小,H2CO3浓度应逐渐增大,但最终浓度不可能为1.0mol/L,故A错误;
B.酸性条件下,能存在大量碳酸,碱性条件下,存在大量碳酸根离子,因为二者存在环境不同,所以H2CO3和CO32-在溶液中不能大量共存,故B正确;
C、等体积的1.0mol?L-1 HCl溶液和1.0mol?L-1碳酸钠溶液混合时恰好反应生成碳酸氢钠,碳酸氢钠溶液呈碱性,故C正确;
D.根据图象知,pH为6.37时,该溶液中:c(H2CO3)=c(HCO3-);在pH为10.25时,该溶液中:c(CO32-)=c(HCO3-),故D正确;
故选A.
B.酸性条件下,能存在大量碳酸,碱性条件下,存在大量碳酸根离子,因为二者存在环境不同,所以H2CO3和CO32-在溶液中不能大量共存,故B正确;
C、等体积的1.0mol?L-1 HCl溶液和1.0mol?L-1碳酸钠溶液混合时恰好反应生成碳酸氢钠,碳酸氢钠溶液呈碱性,故C正确;
D.根据图象知,pH为6.37时,该溶液中:c(H2CO3)=c(HCO3-);在pH为10.25时,该溶液中:c(CO32-)=c(HCO3-),故D正确;
故选A.
点评:本题考查学生的识图和应用能力,明确图象中pH与离子的浓度关系是解答本题的关键,难度中等.

练习册系列答案
相关题目
下列对有机物结构或性质的描述,错误的是( )
| A、2-甲基-2-丁烯不存在顺反异构体 |
| B、羟基(-OH)和氢氧根(OH)的电子数相同 |
| C、苯酚钠溶液中通入CO2生成苯酚,则苯酚的酸性比碳酸弱 |
| D、光照下2,2-二甲基丙烷与Br2反应,其一溴取代物只有一种 |
化合物A、B、C、D各由两种元素组成,甲、乙、丙是三种单质.这些常见的化合物与单质之间存在如下关系(已知化合物C是一种有机物),以下结论不正确的是( )


| A、如图所示的五个转化关系中,有三个是化合反应 |
| B、上述转化关系所涉及的化合物中有一种是电解质 |
| C、甲、乙、丙三种单质的晶体不一定均是分子晶体 |
| D、如图所示的五个转化关系中,均为放热反应 |
 1993年一位农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.一位化学家由此得到启发,从腐败草料中提取出结构简式为(如图)的双香豆素.关于双香豆素的下列推论中错误是( )
1993年一位农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.一位化学家由此得到启发,从腐败草料中提取出结构简式为(如图)的双香豆素.关于双香豆素的下列推论中错误是( )| A、有望将它发展制得一种抗凝血药 |
| B、它无臭并略具芳香味,因而可用来制备致命性出血型的杀鼠药 |
| C、1mol双香豆素在碱性条件下水解可消耗NaOH4mol |
| D、它易溶于水、乙醇、乙醚等有机溶剂 |
下列关于能量变化的说法正确的是( )
| A、相同质量的水和冰相比较,冰的能量高 |
| B、化学反应过程中能量的变化只有吸热和放热两种表现形式 |
| C、化学反应既遵循质量守恒,也遵循能量守恒 |
| D、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
下列关于蛋白质的叙述不正确的是( )
| A、蛋白质溶液中加入饱和的硫酸铵溶液,蛋白质析出,如再加水能溶解 |
| B、蛋白质中的蛋白质分子能透过滤纸,但不能透过半透膜 |
| C、重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒 |
| D、浓硝酸溅在皮肤上,能使皮肤呈黄色是由于蛋白质与浓硝酸发生了颜色反应 |
常温下,由水电离出的c(OH-)=1×10-13mol/L的溶液中,可能大量共存的离子组是( )
| A、Cl-、NH4+、Na+、K+ |
| B、Fe3+、CH3COO-、K+、Ba2+ |
| C、CO32-、SO42-、Cl-、Na+ |
| D、NH4+、Mg2+、CO32-、Cl- |
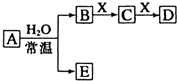 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去). A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素.它们间的反应关系如下图所示.(除(2)外,反应均在常温下进行)
A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素.它们间的反应关系如下图所示.(除(2)外,反应均在常温下进行)