题目内容
2.金属Na投入下列溶液中,既有气体又有白色沉淀产生的是( )| A. | CuSO4 | B. | MgCl2 | C. | FeCl3 | D. | NaCl |
分析 根据钠的化学性质:与水、酸、盐溶液的反应,利用2Na+2H2O=2NaOH+H2↑及生成的碱与盐的反应来得出反应现象.
解答 解:A、因钠与溶液中的水反应,生成物为氢氧化钠和氢气,2Na+2H2O=2NaOH+H2↑,有气体产生;而氢氧化钠与硫酸铜溶液能产生蓝色沉淀,故A错误;
B、因为钠的化学性质活泼,投入MgCl2溶液中后,钠首先与水反应生成氢氧化钠和氢气,然后氢氧化钠与MgCl2生成氢氧化镁白色的沉淀,故B正确;
C、因钠与溶液中的水反应,生成物为氢氧化钠和氢气,2Na+2H2O=2NaOH+H2↑,有气体产生;而氢氧化钠与FeCl3溶液能产生红褐色沉淀,故C错误;
D、因钠能与溶液中的水反应,生成物为氢氧化钠和氢气,2Na+2H2O=2NaOH+H2↑,有气体产生,但氢氧化钠与NaCl溶液不反应,故D错误.
故选B.
点评 本题考查了钠的性质,钠与碱、盐的反应中首先考虑与溶液中的水反应,然后再看生成的氢氧化钠能否与碱、盐本身反应.本题比较简单.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
7.下列说法正确的是( )
| A. | 金刚石和石墨互为同分异构体,熔点和硬度都很高 | |
| B. | 12C、13C、14C是碳元素的三种核素,互称为同位素 | |
| C. | 乙醇和二甲醚(CH3-O-CH3)互为同系物 | |
| D. | C4H10的一氯代物只有一种 |
8.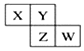 如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
 如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )| A. | X、Y对应的氧化物都是酸性氧化物 | |
| B. | X的氧化物不能与Mg发生化学反应 | |
| C. | Z比Y更容易与氢气化合 | |
| D. | W与X形成的化合物中化学键类型为共价键 |
5.关于实验,下列说法正确的是( )
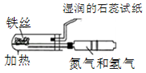 | 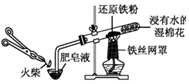 |
| A.模拟工业制氨气并检验产物 | B.一段时间后,试管中固体变为红棕色 |
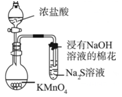 | 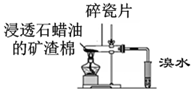 |
| C.可用所示装置比较KMnO4、Cl2、S的氧化性强弱 | D.若溴水褪色则证明石蜡油分解产生乙烯 |
| A. | A | B. | B | C. | C | D. | D |
12. 短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次增加.甲、乙、丙、丁是由这些元素组成的二元化合物,乙为无色气体,丙为无色液体,丁为淡黄色固体.戊是元素Y的单质,是空气的主要成分,乙遇空气变红棕色,丁与丙反应有戊生成;己是元素Z的单质.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径Z>X>Y>W | B. | 丙的热稳定性不如甲 | ||
| C. | X的最高价氧化物的水化物为强酸 | D. | Z的最高价氧化物的水化物为强碱 |
14.下列依据实验目的所设计的实验操作中正确的是( )
| A. | 检验NaCl中含有Na2CO3,加水溶解 | |
| B. | 鉴别NaCl和Na2CO3溶液,加适量盐酸 | |
| C. | 除去CaO中的CaCO3,加足量稀盐酸 | |
| D. | 除去CO2中少量的CO,通入O2,点燃 |
11.设NA表示阿佛加德罗常数,下列说法正确的是( )
| A. | 1mol CaC2中有3NA个离子 | |
| B. | 1mol SiO2中含有2NA个共价键 | |
| C. | 1L 1mol/L CH3COONa溶液中含NA个CH3COO-离子 | |
| D. | 42g C2H4和C3H6的混合物中一定含有6NA个氢原子 |
12.将3.20g Cu跟50.0mL l0.0mol/L的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有xmolH+,则此时溶液中合NO3-的物质的量为( )
| A. | xmol | B. | (x+0.1)mol | C. | 2xmol | D. | 0.1xmol |
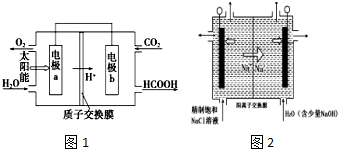 碳及其化合物与人类的生活、生产紧密联系.
碳及其化合物与人类的生活、生产紧密联系.