题目内容
7. 碳及其化合物与人类的生活、生产紧密联系.
碳及其化合物与人类的生活、生产紧密联系.(1)已知1g甲烷完全燃烧生成稳定的氧化物时放出Q kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-16Q kJ/mol
(2)已知:C(s)+H2O(g)═CO(g)+H2(g)△H=+130kJ•mol-1,
2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1.断开1mol H-H键、O═O键分别需要吸收436kJ、496kJ的热量,则断开1mol O-H键需要吸收的热量为C
A.332kJ B.118kJ
C.462kJ D.360kJ
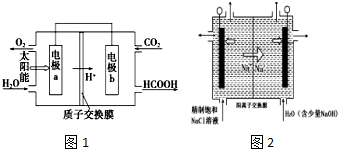
(3)以CO2和H2O为原料制备HCOOH和O2的原电池原理如图1.电极a、b表面发生的电极反应式分别为:
a:2H2O-4e-═O2↑+4H+,b:CO2+2H++2e-=HCOOH.
(4)图2中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2气体.则阳极产生ClO2的电极反应式为Cl--5e-+2H2O=ClO2↑+4H+,用平衡移动原理解释阴极区pH增大的原因:在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O?OH-+H+的平衡向右移动,OH-浓度增大,pH增大.
分析 (1)1g甲烷完全燃烧生成稳定的氧化物时放出Q kJ的热量,则1mol甲烷完全燃烧,放出热量QkJ×16=16QkJ,结合焓变为负极物质的状态书写热化学方程式,以此来解答;
(2)根据盖斯定律计算水分解反应的焓变,化学反应的焓变△H=反应物的键能之和-生成物键能之和进行计算;
(3)由图可知,左室投入水,生成氧气与氢离子,电极a表面发生氧化反应,为负极,右室通入二氧化碳,酸性条件下生成HCOOH,电极b表面发生还原反应,为正极;
(4)由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;电解中H+浓度减小,使得H2O?OH-+H+的平衡向右移动.
解答 解:(1)1g甲烷完全燃烧生成稳定的氧化物时放出Q kJ的热量,则1mol甲烷完全燃烧,放出热量QkJ×16=16QkJ,则表示燃烧热的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-16QkJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-16Q kJ/mol;
(2)已知①C(s)+H2O(g)═CO(g)+H2(g)△H=+130kJ•mol-1,
②2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
①×2-②得:2H2O(g)═O2(g)+2H2(g)△H=(2×130+220)kJ•mol-1=480kJ•mol-1,
设O-H键能为akJ•mol-1,则4a-496-2×436=480,
解得a=462.
故选C;
(3)由图可知,左室投入水,生成氧气与氢离子,电极a表面发生氧化反应,为负极,电极反应式为2H2O-4e-═O2↑+4H+,右室通入二氧化碳,酸性条件下生成HCOOH,电极b表面发生还原反应,为正极,电极反应式为2CO2+4e-+4H+═2HCOOH,
故答案为:2H2O-4e-═O2↑+4H+;CO2+2H++2e-=HCOOH;
(4)由题意可知,阳极氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+;电解中阴极H+浓度减小,使得H2O?OH-+H+的平衡向右移动,溶液的pH增大,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O?OH-+H+的平衡向右移动,OH-浓度增大,pH增大.
点评 本题考查热化学方程式的书写、盖斯定律的应用以及化学反应的能量和化学键键能之间的关系以及电化学原理等,为高频考点,侧重分析与应用能力的考查,注意知识的迁移和应用是关键,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 氯化铵的电子式: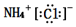 | B. | 中子数为18的硫原子:${\;}_{16}^{18}$S | ||
| C. | 水分子的球棍模型: | D. | 乙烯的结构简式:CH2=CH2 |
| A. | 可利用农作物秸秆制取燃料乙醇 | |
| B. | 可将回收的地沟油加工制成生物柴油 | |
| C. | 向燃煤中加入一些生石灰后可减少温室气体的排放 | |
| D. | 废旧钢材焊接前,可依次用饱和Na2CO3、NH4Cl溶液处理焊点 |
| A. | CuSO4 | B. | MgCl2 | C. | FeCl3 | D. | NaCl |
| A. | 常温常压下,11.2L NH3所含的原子数为2NA | |
| B. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L H2中所含原子数为NA | |
| D. | 1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等 |
| A. | 向小苏打溶液中加入甲酸溶液:HCO3-+H+═CO2↑+H2O | |
| B. | 甲酸苯酯与银氨溶液水浴加热的化学方程式: | |
| C. |  在足量烧碱液中水解: 在足量烧碱液中水解: +2OH-→ +2OH-→ +CH3COO-+2H2O +CH3COO-+2H2O | |
| D. | 向C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| A. | NaAlO2溶液中加入过量氨水 | |
| B. | Al 2(SO 4) 3溶液中加入过量KOH溶液 | |
| C. | FeCl2溶液中加入过量氨水 | |
| D. | MgSO4溶液中加入过量KOH溶液 |



