题目内容
8.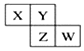 如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )
如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是( )| A. | X、Y对应的氧化物都是酸性氧化物 | |
| B. | X的氧化物不能与Mg发生化学反应 | |
| C. | Z比Y更容易与氢气化合 | |
| D. | W与X形成的化合物中化学键类型为共价键 |
分析 X、Y、Z、W均为短周期元素,若X原子的最外层电子是内层电子数的2倍,则X原子有2个电子层,最外层电子数为4,所以X为C元素,根据X、Y、Z、W在周期表中相对位置可知,Y为N元素,Z为P元素,W为S元素,结合元素性质的递变规律分析解答.
解答 解:由以上分析可知X为C元素,Y为N元素,Z为P元素,W为S元素,
A.X、Y对应的氧化物如分别为CO、NO等,则为不成盐氧化物,故A错误;
B.二氧化碳可与镁反应生成氧化镁、C等,故B错误;
C.非金属性N>P,N更容易与氢气化合,故C错误;
D.W与X形成的化合物为CS2,为共价化合物,化学键类型为共价键,故D正确.
故选D.
点评 本题考查位置结构性质关系应用,为高考常见题型和高频考点,侧重考查学生的分析能力,X是解答本题的突破口,明确短周期及元素在周期表中的位置来推断,注意基础知识的理解掌握.

练习册系列答案
相关题目
18.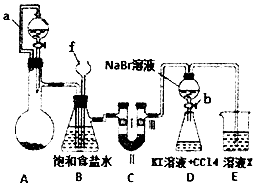 实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:
实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:
(1)仪器f的名称长颈漏斗.
(2)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr207),还原产物是CrCi3,写出A中离子方程式:Cr2O72-+l4H++6Cl-═2Cr3++3C12↑+7H2O.
(3)B装置的作用除了用来除去氯气中的氯化氢外还有作安全瓶,检测实验过程中装置是否堵塞.
(4)装置C的作用是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是③(填序号)
(5)利用D装置证明溴的非金属性比碘强的实验操作是:实验完毕,打开活塞b,使少量液体流入锥形瓶,关闭活塞b,振荡锥形瓶,现象是静罝分层,下层液体呈紫红色.(补充完整上述实验操作和现象)
(6)D装置进行实验时存在的明显不足是没有排除氯气对溴单质与KI反应的干扰.
 实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:
实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:(1)仪器f的名称长颈漏斗.
(2)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr207),还原产物是CrCi3,写出A中离子方程式:Cr2O72-+l4H++6Cl-═2Cr3++3C12↑+7H2O.
(3)B装置的作用除了用来除去氯气中的氯化氢外还有作安全瓶,检测实验过程中装置是否堵塞.
(4)装置C的作用是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是③(填序号)
| ① | ② | ③ | ④ | |
| I | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| II | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| II! | 干燥的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 干燥的红纸条 |
(6)D装置进行实验时存在的明显不足是没有排除氯气对溴单质与KI反应的干扰.
16.20℃时,H2S的饱和溶液1L,其浓度为0.1mol/L,若要使溶液的pH增大的同时c(S2-)增大,可采取的措施是( )
| A. | 加入适量的水 | B. | 加入适量的NaOH固体 | ||
| C. | 通入适量的SO2 | D. | 加入适量的CuSO4固体 |
3.下列有机反应只有一种主要生成物(有机物)的是( )
| A. | CH3CH2CH2Cl在碱性溶液中水解 | |
| B. | CH2═CH-CH═CH2与H2按物质的量之比为1:1进行反应 | |
| C. | CH3CH═CH2与HCl加成 | |
| D. |  与NaOH的醇溶液共热 与NaOH的醇溶液共热 |
20.下列叙述中正确的是( )
| A. | 由乙酸和乙醇生成乙酸乙酯的反应类型和由溴乙烷生成乙烯的反应类型相同 | |
| B. | 糖类、油脂和蛋白质均能发生水解反应 | |
| C. | 丙烯在一定条件下可与氯气发生取代反应生成3-氯丙烯 | |
| D. | 甲苯与氯气在光照下发生取代反应主要生成2,4二氯甲苯 |
2.金属Na投入下列溶液中,既有气体又有白色沉淀产生的是( )
| A. | CuSO4 | B. | MgCl2 | C. | FeCl3 | D. | NaCl |
3.化学与生产和生活密切相关,下列说法错误的是( )
| A. | 从海水中可以获得NaCl,NaCl是生产纯碱的原料 | |
| B. | 硅的晶体可以作为光电转换材料用于太阳能电池 | |
| C. | 明矶净水的原理和“84”消毒液的原理相同 | |
| D. | 燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
 在5-氨基四唑(
在5-氨基四唑(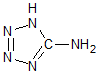 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.


