题目内容
I、A、B、C、D四种可溶性盐,其阳离子分别是Na+、Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3-中的某一种.现做以下实验:
①将四种盐各取少量,分别溶于盛有5mL蒸馏水的四支试管中,只有B盐溶液呈蓝色.
②分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象.
(1)根据上述事实,推断这四种盐的化学式:A ,D .
(2)写出实验步骤②中产生较多气泡现象的离子反应方程式: .
II、有一包白色固体物质,可能含有CuSO4、Na2SO4、KNO3、Na2CO3、NH4Cl中的一种或几种,现进行如下实验:
(1)将白色固体溶于水中,得到无色透明溶液.
(2)取少量上述溶液两份,其中一份滴加BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀没有溶解.另一份溶液中滴加NaOH溶液,加热,产生刺激性气味的气体.根据以上实验现象可知,该白色固体中一定含有 ,一定没有 ,写出产生气体的离子反应方程式 .
①将四种盐各取少量,分别溶于盛有5mL蒸馏水的四支试管中,只有B盐溶液呈蓝色.
②分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象.
(1)根据上述事实,推断这四种盐的化学式:A
(2)写出实验步骤②中产生较多气泡现象的离子反应方程式:
II、有一包白色固体物质,可能含有CuSO4、Na2SO4、KNO3、Na2CO3、NH4Cl中的一种或几种,现进行如下实验:
(1)将白色固体溶于水中,得到无色透明溶液.
(2)取少量上述溶液两份,其中一份滴加BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀没有溶解.另一份溶液中滴加NaOH溶液,加热,产生刺激性气味的气体.根据以上实验现象可知,该白色固体中一定含有
考点:常见阳离子的检验,常见阴离子的检验,几组未知物的检验
专题:物质检验鉴别题
分析:Ⅰ、B盐的溶液呈蓝色,说明B盐中含有Cu2+,分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,说明A盐中含有Ag+;C盐溶液中有较多气泡产生,说明C盐中含有CO32-;又A、B、C、D四种盐均为可溶性盐,故A盐为AgNO3;C盐为Na2CO3,B盐为CuSO4;D盐为BaCl2,以此解答该题;
Ⅱ、无色透明溶液中一定不含有硫酸铜,硫酸钡是白色不溶于硝酸的沉淀,铵盐和强碱在加热的条件下会生成氨气.
Ⅱ、无色透明溶液中一定不含有硫酸铜,硫酸钡是白色不溶于硝酸的沉淀,铵盐和强碱在加热的条件下会生成氨气.
解答:
解:Ⅰ、(1)B盐的溶液呈蓝色,说明B盐中含有Cu2+,分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,说明A盐中含有Ag+;C盐溶液中有较多气泡产生,说明C盐中含有CO32-;又A、B、C、D四种盐均为可溶性盐,故A盐为AgNO3;C盐为Na2CO3,B盐为CuSO4;D盐为BaCl2,以此解答该题.
故答案为:AgNO3;BaCl2;
(2)实验步骤②中产生较多的气泡,该气泡为二氧化碳,离子反应方程式为:CO32-+2H+=CO2↑+H2O,
故答案为:CO32-+2H+=CO2↑+H2O;
II、(1)将白色固体溶于水中,得到无色透明溶液,则一定不含有硫酸铜;
(2)取少量上述溶液两份,其中一份滴加BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀没有溶解,则该沉淀是硫酸钡,一定含有硫酸钠,一定不含有碳酸钠,因为碳酸钡可以溶于硝酸中,滴加NaOH溶液加热,闻到有刺激性气味的气体产生,该气体是氨气,则一定含有铵根离子,即一定含有氯化铵,离子反应为OH-+NH4+
NH3↑+H2O.
故答案为:Na2SO4、NH4Cl;CuSO4、Na2CO3;OH-+NH4+
NH3↑+H2O.
故答案为:AgNO3;BaCl2;
(2)实验步骤②中产生较多的气泡,该气泡为二氧化碳,离子反应方程式为:CO32-+2H+=CO2↑+H2O,
故答案为:CO32-+2H+=CO2↑+H2O;
II、(1)将白色固体溶于水中,得到无色透明溶液,则一定不含有硫酸铜;
(2)取少量上述溶液两份,其中一份滴加BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀没有溶解,则该沉淀是硫酸钡,一定含有硫酸钠,一定不含有碳酸钠,因为碳酸钡可以溶于硝酸中,滴加NaOH溶液加热,闻到有刺激性气味的气体产生,该气体是氨气,则一定含有铵根离子,即一定含有氯化铵,离子反应为OH-+NH4+
| ||
故答案为:Na2SO4、NH4Cl;CuSO4、Na2CO3;OH-+NH4+
| ||
点评:本题考查了混合物组成的推断,完成此题,可以结合题干提供的实验现象根据物质的性质进行,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 《Inorganic Syntheses》(无机合成)一书中,有一如图所示的装置,用以制备某种干燥的纯净气体.该装置中所装的药品正确的是( )
《Inorganic Syntheses》(无机合成)一书中,有一如图所示的装置,用以制备某种干燥的纯净气体.该装置中所装的药品正确的是( )| A、A中装浓盐酸,B中装浓硫酸 |
| B、A中装浓硫酸,B中装浓盐酸 |
| C、A中装氢氧化钠浓溶液,B中装浓氨水 |
| D、A中装浓氨水,B中装氢氧化钠浓溶液 |
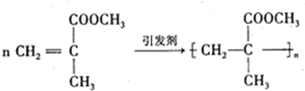
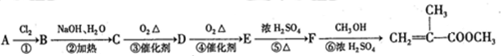 ,
,
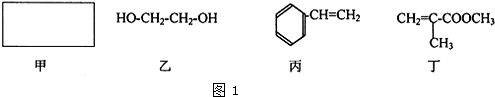
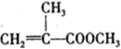 是有机玻璃的单体.下列物质属甲基丙烯酸甲酯同分异构体的是
是有机玻璃的单体.下列物质属甲基丙烯酸甲酯同分异构体的是 、④
、④
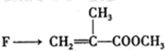


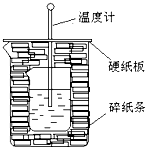 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: