题目内容
4.某研究小组利用如图1装置探究SO2和Fe(NO3)3溶液的反应原理.回答下列问题: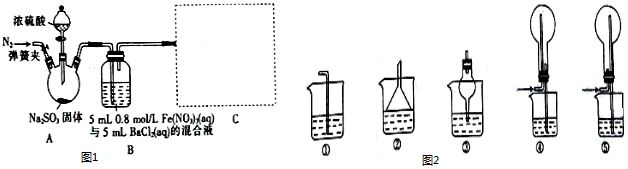
(1)在实验室中,欲配制250g 70%的浓硫酸,需要的玻璃仪器除量筒、烧杯外,还需要有量筒和胶头滴管,装置A中盛放浓硫酸的仪器名称是分液漏斗.
(2)往三颈烧瓶中通入N2的操作在滴加浓硫酸之前(填“之前”或“之后”),其目的是排除空气对实验的干扰.
(3)三颈烧瓶中发生反应的化学方程式为Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O,该反应中浓硫酸表现出的性质为强酸性.
(4)SO2易溶于水,图2装置可用于C处虚线框内吸收尾气的是②或③或④(填编号).
(5)装置B中产生白色沉淀的原因有两种可能.若要证明Fe3+能氧化SO2,则需要改进的地方是把装置B中的Fe(NO3)3溶液替换为FeCl3溶液,改进后若得到肯定结论,则装置B中发生反应的离子方程式为SO2+2Fe3++2H2O=2Fe2++SO42-+4H+、SO42-+Ba2+=BaSO4↓.
分析 (1)配制一定质量分数的溶液所需的玻璃仪器有:烧杯、玻璃棒、量筒和胶头滴管,装置A图中盛放浓硫酸的仪器是分液漏斗;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出;
(3)亚硫酸钠和浓硫酸反应生成二氧化硫和硫酸钠,浓硫酸表现出强酸性;
(4)尾气主要为二氧化硫,所以C处虚线框内画出尾气吸收的装置中试剂需选择碱性溶液,同时需有防倒吸的装置;
(5)Fe3+和NO3-都具有氧化性,都可与二氧化硫反应,可把装置B中的Fe(NO3)3溶液替换为FeCl3溶液.
解答 解:(1)欲配制250g 70%的浓硫酸,需要的玻璃仪器除量筒、烧杯外,还需要有量筒和胶头滴管,装置A图中盛放浓硫酸的仪器是分液漏斗,
故答案为:量筒和胶头滴管;分液漏斗;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,
故答案为:之前;排除空气对实验的干扰;
(3)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O,强酸制弱酸,浓硫酸表现出强酸性,
故答案为:Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O;强酸性;
(4)尾气的主要成分为二氧化硫,通常用氢氧化钠溶液吸收,为防止倒吸,所以装置可选图2中的②或③或④,
故答案为:②或③或④;
(5)两种离子都氧化二氧化硫,即SO2和Fe3+、酸性条件下NO3-都反应;可把装置B中的Fe(NO3)3溶液替换为FeCl3溶液,装置B中反应的离子方程式是SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,SO42-+Ba2+=BaSO4↓,
故答案为:把装置B中的Fe(NO3)3溶液替换为FeCl3溶液;SO2+2Fe3++2H2O=2Fe2++SO42-+4H+;SO42-+Ba2+=BaSO4↓.
点评 本题探究SO2和Fe(NO3)3溶液的反应原理实验,题目难度中等,注意把握物质的性质为解答该题的关键,学习中注意相关知识的积累,培养了学生灵活运用知识的能力.

| A. | 历史上很多种元素是通过原子光谱发现的 | |
| B. | 鉴别晶体与非晶体,最为科学的方法是X射线衍射法 | |
| C. | 前36号元素中基态电子排布未成对电子数最多的元素,在第四周期第IIIB族 | |
| D. | 金属性越强的金属元素,第一电离能不一定就越小 |
| A. | SO2在葡萄糖中作抗氧化剂 | B. | Fe3O4常用作红色油漆和涂料 | ||
| C. | SiO2可制成太阳能电池 | D. | 漂粉精可用于游泳池的消毒 |
| A. | c=$\frac{2000ρa}{M}$ | B. | a%=$\frac{c}{2000ρ}$ | C. | M=$\frac{1000ρa%}{c}$ | D. | $S=\frac{100cM}{2000ρ-cM}$ |
| A. | 氯气通入水中:Cl2 +H2O?2H++Cl-+ClO- | |
| B. | 少量的CO2 通入氨水中:CO2+NH3•H2O=NH4++HCO3- | |
| C. | 向NaHSO4溶液中加入过量Ba(OH)2溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 用稀硝酸除去试管内壁银:3Ag+4H++NO3-═3Ag++NO↑+2H2O |
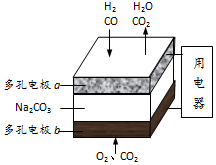
| A. | b是电池的负极 | |
| B. | a电极的反应为:CO+CO32ˉ-2eˉ═2CO2,H2+CO32ˉ-2eˉ═H2O+CO2 | |
| C. | a电极上每消耗22.4L原料气,电池中转移电子数约为2×6.02×1023 | |
| D. | a、b两极消耗的气体的物质的量之比是1:1 |
| A. | 铁与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 加入反应物,则单位体积内活化分子百分数增大,化学反应速率增大 | |
| C. | 过程的自发性只能用于判断其方向性,不能确定其是否一定会发生和发生的速率 | |
| D. | 中和反应放热说明中和反应前后能量不守恒 |
| A. | 水是弱电解质 | B. | 可燃冰是可以燃烧的水 | ||
| C. | 氢氧两种元素只能组成水 | D. | 0℃时冰的密度比液态水的密度大 |