题目内容
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料.以CH4和H2O为原料制备甲醇和二甲醚的工业流程如下: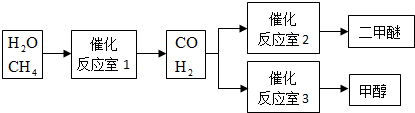
根据要求回答下列问题:
(1)“反应室1”在一定条件下反应的化学方程式为 .
(2)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
完成热化学反应方程式:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g);△H= .

根据要求回答下列问题:
(1)“反应室1”在一定条件下反应的化学方程式为
(2)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
完成热化学反应方程式:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g);△H=
考点:热化学方程式
专题:化学反应中的能量变化
分析:(1)由工艺流程图可知,催化反应室1中发生的反应是甲烷与水在一定条件下生成一氧化碳与氢气;
(2)据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减.
(2)据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减.
解答:
解:(1)由工艺流程图可知,催化反应室1中发生的反应是甲烷与水在一定条件下生成一氧化碳与氢气,反应方程式为:H2O+CH4
CO+3 H2,
故答案为:H2O+CH4
CO+3H2;
(2)已知:①CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol,
故答案为:-246.4kJ/mol.
| ||
故答案为:H2O+CH4
| ||
(2)已知:①CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol,
故答案为:-246.4kJ/mol.
点评:本题考查反应热的计算等,难度中等,注意盖斯定律的应用是解题的关键.

练习册系列答案
相关题目
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)?2CO2(g)+S(l)△H<0.若反应在密闭容器中进行,下列有关说法不正确的是( )
| A、若体积固定,平衡前,随着反应的进行,容器内气体的密度减小 |
| B、平衡时,其他条件不变,充入一定量的SO2,正反应速率加快 |
| C、平衡时,其他条件不变,加入催化剂可提高SO2的转化率 |
| D、平衡时,其他条件不变,缩小容器体积,平衡正向移动 |
常温下,对于pH=11的NaOH溶液,下列说法错误的是( )
| A、c(OH-)=c(Na+)+c(H+) |
| B、该溶液中的c(OH-)=1.0×10-3mol?L-1 |
| C、与等体积pH=3的醋酸混合后所得溶液显碱性 |
| D、与等体积0.001 mol?L-1的氯化铵混合后所得溶液中:c(Na+)>c(NH4+) |
下列溶液中有关物质的量浓度关系正确的是( )
| A、0.1 mol/L pH=3的H2A溶液与0.01 mol/L pH=11的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+2c(A2-) |
| B、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
| C、物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
| D、0.1 mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
标准状况下,在三个烧瓶内分别装有纯净干燥的NH3、含一半空气的氯化氢气体、NO2和O2体积比为4:1的混合气体.然后分别做喷泉实验,实验结束后假设三个烧瓶中所得溶液不扩散,则它们的物质的量浓度之比为( )
| A、2:1:2 | B、5:5:4 |
| C、1:1:1 | D、无法确定 |


 )的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氧.
)的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氧.