题目内容
5.在1L水溶液中,含有0.1mol氯化钠和0.1mol氯化镁,该溶液中Cl-的物质的量浓度为( )| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
分析 先计算氯离子的物质的量,再根据C=$\frac{n}{V}$计算氯离子浓度.
解答 解:0.1molNaCl和0.1molMgCl2中氯离子的物质的量=(0.1×1+0.1×2)mol=0.3mol,则氯离子浓度=$\frac{0.3mol}{1L}$=0.3mol/L,故选C.
点评 本题考查了物质的量浓度的计算,注意氯化镁的化学式中含有两个氯离子,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.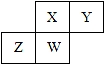 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| D. | 元素Y、Z形成的化合物是制造光电池的主要材料 |
13.若甲烷与氯气以物质的量之比1:1混合,在光照下得到的有机取代产物是( )
①CH3Cl、②CH2C12、③CHCl3、④CCl4.
①CH3Cl、②CH2C12、③CHCl3、④CCl4.
| A. | 只有① | B. | 只有③ | C. | ①②③的混合物 | D. | ①②③④的混合物 |
20.CH4与Cl2在光照条件下反应生成多种产物,其中物质的量最大的是( )
| A. | HCl | B. | CCl4 | C. | CH3Cl | D. | H2 |
10.体积为VmL,密度为ρg/cm3的溶液,含有相对分子质量为M的溶质mg,其物质的量浓度为cmol/L,质量分数为w%,下列表示不正确的是( )
| A. | c=$\frac{w•1000•ρ}{M}$ | B. | m=$\frac{Vρw}{100}$ | C. | c=$\frac{1000m}{(V•M)}$ | D. | w=$\frac{cM}{1000ρ}$ |
17.下列物质中,只含离子键的是( )
| A. | NaOH | B. | MgCl2 | C. | H2O | D. | HCl |
14.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 3.2g由O2和O3组成的混合物中含有氧原子的数目为0.2NA | |
| B. | 0.1mol苯中含有碳碳双键的数目为0.3NA | |
| C. | 标准状况下,11.2L三氯甲烷中含有分子的数目为0.5NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
13.化学键是一种作用力,下列不属于化学键的是( )
| A. | 氢键 | B. | 离子键 | C. | 极性共价键 | D. | 非极性共价键 |