题目内容
4. 如图是个乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料分别是石墨和铁工作时M、N两个电极的质量都不减少,请回答:
如图是个乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料分别是石墨和铁工作时M、N两个电极的质量都不减少,请回答:(1)工作时,乙池中电子流出的电极是N(填“M”或“N”);
(2)甲池中通入乙醇的铂电极名称是负极(填“正极”或“负极”),通入O2的铂电极上的反应式为O2+2H2O+4e-=4OH-;
(3)乙池中M的电极材料是铁,N的电极反应式为4OH--4e-=O2↑+2H2O;
(4)若乙池中某电极析出金属银4.32g时,则甲池中理论上消耗氧气0.224L(标准状况下);
(5)若在常温常压下,1gCH3CH2OH燃烧生成CO2和液态H2O时放出29.71kJ热量,该反应的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.7kJ/mol.
分析 碱性乙醇燃料电池中通入乙醇的一极为原电池的负极,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为石墨材料,M为电解池的阴极,为铁电极,电解硝酸银溶液时,阴极反应式为Ag++e-=Ag,阳极反应式为4OH--4e-=O2↑+2H2O;结合电子的转移的物质的量的判断进行计算;根据1g C2H5OH燃烧放出的热量求出1mol燃烧放热,再写出热化学方程式.
解答 解:碱性乙醇燃料电池中通入乙醇的一极为原电池的负极,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为石墨材料,N为阳极,电极反应式是4OH--4e-=O2↑+2H2O,M为阴极,电极材料是Fe,电极反应式为Ag++e-=Ag,则乙池的总反应式为4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag↓+O2↑+4H+,
(1)乙池中N为阳极,电子流出的电极是N极,故答案为:N;
(2)碱性乙醇燃料电池通入乙醇的一极为原电池的负极,通入氧气的一极为原电池的正极,O2+2H2O+4e-=4OH-,故答案为:负极;O2+2H2O+4e-=4OH-;
(3)乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,反应方程式为4OH--4e-=O2↑+2H2O;则应为石墨材料,M为电解池的阴极,为铁电极,故答案为:铁;4OH--4e-=O2↑+2H2O;
(4)n(Ag)=$\frac{4.32g}{108g/mol}$=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e-=4H2O,则消耗n(O2)=$\frac{1}{4}$×0.04mol=0.01mol,V(O2)=0.01mol×22.4L/mol=0.224L,故答案为:0.224;
(5)1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,则1mol乙醇燃烧放出的热量=$\frac{\frac{29.7kJ}{1g}}{46g/mol}$=1366.7kJ,所以其热化学反应方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.7kJ/mol,
故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.7kJ/mol.
点评 本题考查了原电池原理和电解池原理、热化学方程的书写,明确原电池和电解池电极上发生反应的类型即可分析解答本题,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | H2S | B. | NH3 | C. | CH2Br2 | D. | BF3 |
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl受热分解 ⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.
| A. | ①②④⑥⑦ | B. | ④⑥ | C. | ①④⑤⑧ | D. | ①②④⑤⑥⑦ |
| A. | 加成反应,消去反应,取代反应 | B. | 消去反应,加成反应,取代反应 | ||
| C. | 取代反应,消去反应,加成反应 | D. | 取代反应,加成反应,消去反应 |
【原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验 编号 | 室温下,试管中所加试剂及用量/mL | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L H2SO4溶液 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4的浓度,化学反应速率增大;
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)=1.5×10-2mol/(L•min);
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图l所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
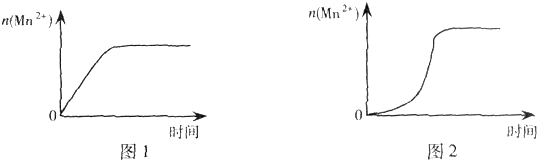
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验 编号 | 室温下,试管中所加试剂及用量/mL | 再向试管中加入少量固体 | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L H2SO4溶液 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
 .请回答:
.请回答:
 ;E的分子式为C10H12O2;F中含氧官能团的名称是酯基、醛基.
;E的分子式为C10H12O2;F中含氧官能团的名称是酯基、醛基. .
.