题目内容
1.硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等.其部分性质如下表:| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;△\;}}{\;}$SO2↑+Cl2↑ |
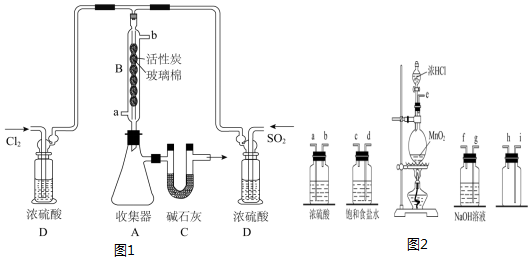
I.实验室合成硫酰氯需要先制取干燥氯气,制备干燥纯净的氯气所用仪器如图1:
(1)上述仪器的连接顺序是:e接d,c接a,b接i,h接j(按气流方向,用小写字母表示).
II.催化合成硫酰氯的实验装置如图 2(夹持仪器已省略):
(2)仪器B冷却水的进口为a(填“a””或“b”),活性炭的作用是催化剂.
(3)装置D除干燥气体外,另一作用是通过观察气泡控制气体流速.若缺少D,则硫酰氯会水解,该反应的化学方程式为SO2Cl2+2H2O═H2SO4+2HCl.
(4)某同学建议将收集器A放在冰水中冷却,你认为该同学的建议是否合理,为什么?合理,防止硫酰氯分解
(5)C处U形管中碱石灰的作用是吸收多余二氧化硫、氯气,防止污染;防止水蒸气进入收集器使产品水解.
III.在氯磺酸中加入四氯化锡加热煮沸,使氯磺酸分解,可用于制取少量硫酰氯.化学方程式为:2ClSO3H$\frac{\underline{催化剂}}{△}$H2SO4+SO2Cl2,此法得到的产品中混有硫酸.
(6)①从分解产物中分离出硫酰氯的方法是蒸馏.
②请设计实验方案检验产品中硫酸的存在(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):
取适量产品充分加热后加水稀释,分成两份,一份滴加紫色石蕊试液变红,另一份加入BaCl2溶液产生白色沉淀,说明含有H2SO4.
分析 I、(1)实验室由二氧化锰和浓盐酸共热制备氯气,制得的氯气混有水蒸气和HCl气体,用饱和食盐水吸收氯化氢气体,用浓硫酸吸收水蒸气,用排空气法收集氯气,最后用氢氧化钠吸收多余的氯气,防止污染空气;
II、(2)根据采用逆流的冷凝效果好,判断冷凝管的进水口;活性炭作催化剂;
(3)D装置的浓硫酸用来干燥气体,防止硫酰氯水解,同时还可以通过观察气泡控制气体流速;若无D,硫酰氯水解为硫酸和盐酸;
(4)硫酰氯受热易分解,可将收集器A放在冰水中冷却;
(5)C处U形管中碱石灰防止空气中的水蒸气进入装置,同时吸收挥发出去的二氧化硫和氯气,防止污染;
III、(6)①二者沸点相差较大,采取蒸馏法进行分离;
②氯磺酸(ClSO3H)分解:2ClSO3H═H2SO4+SO2Cl2,设计实验方案检验产品,需检验氢离子、检验硫酸根离子.
解答 解:I、(1)实验室由二氧化锰和浓盐酸共热制备氯气,制得的氯气混有水蒸气和HCl气体,用饱和食盐水吸收氯化氢气体,用浓硫酸吸收水蒸气,为充分吸收杂质气体,导气管长进短出,用排空气法收集氯气,氯气密度比空气大,导气管长进短出,最后用氢氧化钠吸收多余的氯气,防止污染空气;
故答案为:d;c;a;b;i;h;g;
II.(2)根据采用逆流的冷凝效果好,所以冷凝管中的冷却水进口为a,活性炭作催化剂;
故答案为:a;催化剂;
(3)D装置的浓硫酸用来干燥气体,防止硫酰氯水解,同时还可以通过观察气泡控制气体流速;若无D,硫酰氯水解为硫酸和盐酸.化学方程式为:SO2Cl2+2H2O═H2SO4+2HCl;
故答案为:通过观察气泡控制气体流速;SO2Cl2+2H2O═H2SO4+2HCl;
(4)硫酰氯受热易分解,可将收集器A放在冰水中冷却;
故答案为:合理,防止硫酰氯分解;
(5)二氧化硫、氯气为有毒的酸性气体,产物硫酰氯会水解,所以C处U形管中碱石灰可防止空气中的水蒸气进入装置,同时吸收挥发出去的二氧化硫和氯气;
故答案为:吸收多余二氧化硫、氯气,防止污染;防止水蒸气进入收集器使产品水解;
III、(6)①二者为互溶液体,沸点相差较大,采取蒸馏法进行分离;
故答案为:蒸馏;
②氯磺酸(ClSO3H)分解:2ClSO3H$\frac{\underline{催化剂}}{△}$H2SO4+SO2Cl2,取适量产品充分加热后加水稀释,分成两份,一份滴加紫色石蕊试液变红,另一份加入BaCl2溶液产生白色沉淀,说明含有H2SO4;
故答案为:取适量产品充分加热后加水稀释,分成两份,一份滴加紫色石蕊试液变红,另一份加入BaCl2溶液产生白色沉淀,说明含有H2SO4.
点评 本题考查物质的制备实验和实验设计,为侧重考查学生知识综合应用、根据实验目的及物质的性质进行排列顺、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取于使用,难度中等.

| A. | 1:1 | B. | 3:5 | C. | 2:3 | D. | 3:2 |
| A. | 我国目前最主要的能源是煤炭 | |
| B. | 人体运动所消耗的能量与化学反应无关 | |
| C. | 人类目前所直接利用的能量大部分是由化学反应所产生的 | |
| D. | 煤、石油、天然气是当今世界最重要的三种化石燃料 |
| A. | 3种 | B. | 4 种 | C. | 5 种 | D. | 8种 |
| A. | 2个甲基,可能生成4种一氯代物 | B. | 3个甲基,可能生成3种一氯代物 | ||
| C. | 3个甲基,可能生成5种一氯代物 | D. | 4个甲基,可能生成4种一氯代物 |