题目内容
13.氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700℃的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)(1)上述反应氧化剂是N2,已知该反应每转移1mole-,放出132.6kJ的热量,该方程式的△H=-1591.2kJ/mol.
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是ACD
A.焦炭的质量不再变化 B.N2 和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是BD
A.升高温度 B.降低压强 C.加入更多的SiO2 D.充入N2
(4)该反应的温度控制在1300-1700°C的原因是温度太低,反应速率太低;该反应是放热反应,温度太高,不利于反应向右进行.
(5)某温度下,测得该反应中N2和CO各个时刻的浓度如下,求0-20min内N2的平均反应速率3.70×102mol/(L•min),该温度下,反应的平衡常数K=81.0.
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度mol•L-1 | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol•L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | - | - | - |
分析 (1)氮的化合价降低,所以反应氧化剂是N2,3SiO2 (s)+6C (s)+2N2 (g)?Si3N4 (s)+6CO (g),每转移1mol eˉ放出132.6kJ的热量,化学方程式中电子转移12mol,放热1591.2KJ;
(2)根据平衡状态的特征分析解答;
(3)正反应方向是放热反应和气体体积增大的方向,结合平衡移动的影响因素分析解答;
(4)温度太低,反应速率太低;该反应是放热反应,温度太高,不利于反应向右进行,所以该反应的温度控制在1300-1700°C;
(5)依据化学反应速率概念计算,根据平衡常数列式计算.
解答 解:(1)氮的化合价降低,所以反应氧化剂是N2,3SiO2 (s)+6C (s)+2N2 (g)?Si3N4 (s)+6CO (g),每转移1mol eˉ放出132.6kJ的热量,化学方程式中电子转移12mol,放热1591.2KJ,故答案为:N2,-1591.2 kJ/mol;
(2)A.焦炭的质量不再变化,说明正逆反应速率相等,达平衡状态,故A正确;
B.只要反应发生,N2 和CO速率之比就为1:3,所以不一定平衡,故B错误;
C.生成6molCO等效于生成1mol Si3N4同时消耗1mol Si3N4,正逆反应速率相等,达平衡状态,故C正确;
D.混合气体的密度不再变化,说明气体的质量不变反应达平衡状态,故D正确;
故选:ACD;
(3)A.升高温度,平衡逆向移动,故不选;
B.降低压强,平衡正向移动,故选;
C.加入更多的SiO2,平衡不移动,故不选;
D.充入N2,平衡正向移动,故选;
故选:BD;
(4)温度太低,反应速率太低;该反应是放热反应,温度太高,不利于反应向右进行,所以该反应的温度控制在1300-1700°C,故答案为:温度太低,反应速率太低;该反应是放热反应,温度太高,不利于反应向右进行;
(5)在2L的密闭容器中,测得该反应中N2和CO各个时刻的物质的量,分析数据结合反应速率概念,v(N2)=$\frac{4mol/L-3.26mol/L}{20min}$=0.037mol/L•min;
3SiO2 (s)+6C (s)+2N2 (g)?Si3N4 (s)+6CO (g),
起始量(mol/L) 4 0
变化量(mol/L) 1 3
平衡量(mol/L) 3 3
平衡常数K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$=$\frac{{3}^{6}}{{3}^{2}}$=81.0;
故答案为:3.70×102 mol/(L•min);81.0.
点评 本题考查了化学平衡影响因素分析判断,反应速率计算,平衡常数计算应用,题目难度较大,但综合性强.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①S2- ②Fe2+ ③Fe3+ ④S ⑤Na+ ⑥HClO4⑦Mg.
| A. | ①⑦ | B. | ②④ | C. | ③⑤⑥ | D. | ②④⑤⑥ |
| A. | HX、HY、HZ | B. | HX、HZ、HY | C. | HZ、HY、HX | D. | HY、HZ、HX |
| A. | 盐酸与Na2SiO3溶液混合:SiO32-+2H+═H2SiO3 | |
| B. | Cl2和H2O反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | NO2通入水中:H2O+3NO2═2H++2NO3-+NO | |
| D. | 浓盐酸和二氧化锰共热制Cl2:MnO2+4H++2Cl-═Mn2++Cl2+2H2O |
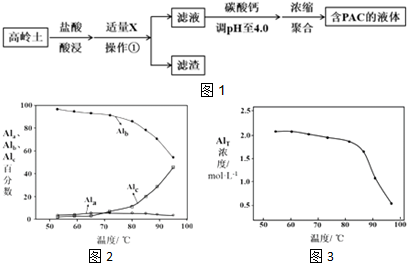
(1)盐酸酸浸所涉及反应的离子方程式是6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O.
(2)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |
根据表中数据解释加入X的主要目的:调节溶液pH至Fe3+完全沉淀,滤渣中主要含有物质的化学式是Fe(OH)3、SiO2.
(3)已知:生成液体PAC的反应为2Al3++m(6-n) Cl-+mn H2O?[Al2(OH)nCl6-n]m+mn H+.用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低.请解释pH偏小液体PAC产率降低的原因:pH偏小时,抑制平衡2Al3++m(6-n)Cl-+mnH2O?[Al2(OH)nCl6-n]m+mnH+正向移动生成PAC.
(4)浓缩聚合得到含PAC的液体中铝的各种形态主要包括:
Ala--Al3+单体形态铝
Alb--[Al2(OH)nCl6-n]m聚合形态铝
Alc--Al(OH)3胶体形态
图2为Al各形态百分数随温度变化的曲线;图3为含PAC的液体中铝的总浓度AlT随温度变化的曲线.
①50-90℃之间制备的液体PAC中,聚合形态铝含量最多.
②当T>80℃时,AlT明显降低的原因是温度升高,导致液体PAC向Al(OH)3沉淀转化.
| A. | 洁净的空气 | B. | 自来水 | C. | 澄清的石灰水 | D. | 冰水混合物 |
| 选项 | 物质 | 杂质 | 除杂试剂 | 操作方法 |
| A | CaCl2溶液 | 稀盐酸 | 过量碳酸钙 | 过滤 |
| B | NaCl溶液 | NaBr | 稍过量氯水、乙醇 | 萃取、分液 |
| C | NaCl溶液 | Na2CO3 | 适量硝酸钙溶液 | 过滤 |
| D | O2 | CO | 氧化铜 | 通过灼热的氧化铜 |
| A. | A | B. | B | C. | C | D. | D |