题目内容
19.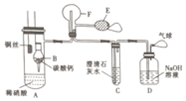 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个被固定的干燥管,内装块状碳酸钙固体;F为一个空的蒸馏烧瓶;E是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个被固定的干燥管,内装块状碳酸钙固体;F为一个空的蒸馏烧瓶;E是用于鼓入空气的双连打气球.(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体.一段时间后,立刻将B装置上提,使之与稀硝酸分离.该组学生设计此步操作的目的为用碳酸钙与稀硝酸反应产生的二氧化碳赶走装置内的空气.
(2)将A中铜丝放入稀硝酸中,装置A中产生的现象为有无色气体产生,一段时间后,装置A中溶液变蓝.用E向F中鼓入空气后,烧瓶F内气体颜色加深.其原因是2NO+O2=2NO2(用化学方程式表示).一段时间后,C中的现象为白色沉淀溶解.
(3)若没有D装置,则造成的后果是污染大气.
分析 (1)一氧化碳极易被氧化,实验时,可先将B装置中CaCO3放入硝酸中,碳酸钙和硝酸反应生成二氧化碳气体,先排出去其中的空气;
(2)铜与稀硝酸反应生成无色气体一氧化氮和蓝色溶液硝酸铜;用E向F中鼓入空气后,烧瓶F内生成二氧化氮气体颜色加深,二氧化碳与澄清石灰水反应生成碳酸钙沉淀,同时二氧化氮与水反应生成硝酸,碳酸钙又溶解于硝酸,所以沉淀又溶解;
(3)装置D是吸收尾气,防止产生大气污染.
解答 解:(1)实验时,可先将B装置中CaCO3放入硝酸中,碳酸钙和硝酸反应生成二氧化碳气体,先排出去其中的空气,以便在E烧瓶中收集到NO,
故答案为:用碳酸钙与稀硝酸反应产生的二氧化碳赶走装置内的空气;
(2)铜与稀硝酸反应生成无色气体一氧化氮和蓝色溶液硝酸铜,所以现象为:有无色气体产生,一段时间后,装置A中溶液变蓝;用E向F中鼓入空气后,烧瓶F内生成二氧化氮气体颜色加深,反应的方程式为:2NO+O2=2NO2,二氧化碳与澄清石灰水反应生成碳酸钙沉淀,同时二氧化氮与水反应生成硝酸,碳酸钙又溶解于硝酸,所以沉淀又溶解,现象为:白色沉淀溶解,
故答案为:有无色气体产生,一段时间后,装置A中溶液变蓝;2NO+O2=2NO2;白色沉淀溶解;
(3)装置D中盛有氢氧化钠溶液,可用与吸收二氧化氮气体,气体中气球可用于吸收不反应的NO,以防止污染空气,所以没有D装置,则造成的后果是污染大气,
故答案为:污染大气.
点评 本题以硝酸的性质为载体综合考查性质实验的设计,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,明确实验目的和原理是解答该题的关键,注意相关实验操作方法的注意事项,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.在密闭容器中,反应2NO2?N2O4在不同条件下的化学平衡情况如图a、图b所示.图a表示恒温条件下c(NO2)的变化情况;图b表示恒压条件下,平衡体系中N2O4的质量分数随温度的变化情况(实线上的任意一点为对应温度下的平衡状态).下列说法正确的是( )
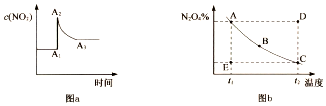

| A. | 其它条件不变时,向平衡体系中充入N2O4,平衡常数增大 | |
| B. | 图a中,A1一A2变化的原因一定是充人了NO2 | |
| C. | 图b中,E点对应状态中,v(正)>v(逆) | |
| D. | 图b中,E→A所需时间为x,D→C所需时间为y,则x<y |
10.标准状况下,若2.8LO2含有n个O2分子,则阿伏加德罗常数为( )
| A. | n/8 | B. | n/16 | C. | 8n | D. | 16n |
4.某溶液中只可能含有下列离子中的几种:Na+、NH4+、SO42-、CO32-、NO3-、Cl-(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(1)第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
(2)第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
(3)在(2)的滤液中滴入AgNO3,产生白色沉淀,加稀硝酸,沉淀不溶解.
下列说法正确的是( )
(1)第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
(2)第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
(3)在(2)的滤液中滴入AgNO3,产生白色沉淀,加稀硝酸,沉淀不溶解.
下列说法正确的是( )
| A. | 该溶液中可能含Na+ | B. | 该溶液中肯定含有NH4+、SO42-、Cl- | ||
| C. | 该溶液中一定不含NO3-、CO3- | D. | 该溶液中一定含有Na+ |
8.在含有大量Fe3+、H+、SO42-的溶液中,还可能大量共存的离子是( )
| A. | Ba2+ | B. | OH- | C. | I- | D. | NH4+ |
9.用下列实验装置进行相应实验,能达到实验目的是( )
| A. | 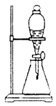 用图所示装置可以将乙醇和水分离 | |
| B. | 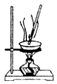 用图所示装置蒸发硫酸铜溶液制备硫酸铜晶体 | |
| C. | 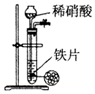 用图所示装置通过稀硝酸与铁反应制取少量的氢气 | |
| D. | 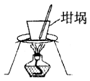 用图所示装置分离氢氧化钙固体中混有的少量氯化铵固体 |
 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.