题目内容
15.在NH4Al(SO4)2溶液中,逐滴滴入Ba(OH)2溶液,沉淀的物质的量随Ba(OH)2溶液体积的变化如图,有关分析正确的是( )
| A. | O~M段反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | 沉淀的质量M>P | |
| C. | N点溶液可与Na+、Fe3+、NO3-、Cl-大量共存 | |
| D. | N~P段溶液的pH逐渐减小 |
分析 设硫酸铝铵[NH4Al(SO4)2]为1mol,则溶液含有NH4+1mol,Al3+1mol,SO42-2mol.
开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入3molOH-,即加入1.5molBa(OH)2,加入的Ba2+为1.5mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(O到M)
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入2molBa(OH)2,加入4molOH-,Al3+反应掉3molOH-,生成Al(OH)31mol,剩余1molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;(M到N)
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使1molAl(OH)3完全溶解,需再加入0.5molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液(N到P);据此结合选项分析.
解答 解:设硫酸铝铵[NH4Al(SO4)2]为1mol,则溶液含有NH4+1mol,Al3+1mol,SO42-2mol.
开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入3molOH-,即加入1.5molBa(OH)2,加入的Ba2+为1.5mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(O到M)
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入2molBa(OH)2,加入4molOH-,Al3+反应掉3molOH-,生成Al(OH)31mol,剩余1molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;(M到N)
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使1molAl(OH)3完全溶解,需再加入0.5molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液(N到P);.
A.由分析可知,从开始到M点,反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,故A正确;
B.由图象可知,M到P点,沉淀的质量逐渐增大,即沉淀的质量M<P,故B错误;
C.N点溶液为氨水溶液,显碱性,与Fe3+能生成氢氧化铁沉淀,所以Fe3+不能大量共存,故C错误.
D.N到P,氢氧化铝沉淀逐渐溶解,溶液为氨水与偏铝酸钡溶液,所以溶液碱性增强,则pH增大,故D错误;
故选A.
点评 本题考查铝化合物的性质及计算,难度比较大,清楚整个反应过程是解题的关键,注意NH4+与Al3+同时存在,OH-首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH-首先与NH4+反应,侧重于考查学生的分析能力和计算能力.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| B. | 25℃时,加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 温度升高,c(HCO3-)减小 |
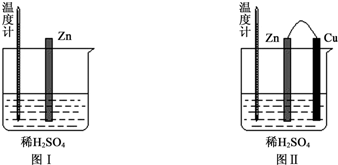
(1)图Ⅰ中发生反应的化学方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度变化及其原因是升高;锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如表,请完成相应实验现象的解释.
| 实验现象 | 解释原因 |
| Cu片上产生了大量气泡 | Zn、Cu构成原电池,H+在Cu片上得电子产生氢气 |
| 温度计指示的温度无明显变化 | 反应中的化学能主要转化成了电能 |
| A. | 电能、蒸汽 | B. | 氢能、风能 | C. | 原煤、石油 | D. | 地热能、潮汐能 |
| A | B | C | D | |
| 阳极 | 石墨棒 | Cu | Cu | Cu |
| 阴极 | 石墨棒 | Fe | 石墨棒 | Pt |
| 电解液 | CuSO4溶液 | H2SO4溶液 | Na2SO4溶液 | H2O |
| A. | A | B. | B | C. | C | D. | D |
| A. | Cl | B. | P | C. | S | D. | Na |
| A. | 质量为30 g | |
| B. | 含有6.02×1023个NO子 | |
| C. | 标准状况下的体积为67.2L | |
| D. | 与足量氧气完全反应,生成6mol NO2 |
 .
.