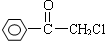题目内容
一定条件下,Fe3+和I-在水溶液中的反应是2I-+2Fe3+?I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动.请设计一种使该反应的化学平衡逆向移动的实验方案 .
考点:化学平衡的影响因素
专题:化学平衡专题
分析:加入CCl4萃取了I2,减小了生成物浓度,反应速率降低,从而使得v(正)>v(逆),导致平衡向正反应方向移动;增大生成物浓度或减小反应物浓度平衡逆向移动.
解答:
解:加入CCl4萃取了I2,减小了生成物浓度,反应速率降低,从而使得v(正)>v(逆),导致平衡向正反应方向移动;
增大生成物浓度或减小反应物浓度平衡逆向移动,加入少许铁粉可以与三价铁离子反应,减小反应物浓度,加入少许碘,增大生成物的浓度,平衡均逆向移动.
故答案为:正反应;加入少许铁粉或加入少许碘.
增大生成物浓度或减小反应物浓度平衡逆向移动,加入少许铁粉可以与三价铁离子反应,减小反应物浓度,加入少许碘,增大生成物的浓度,平衡均逆向移动.
故答案为:正反应;加入少许铁粉或加入少许碘.
点评:本题考查了影响平衡移动的因素,注意加入CCl4萃取了I2,减小了生成物浓度.

练习册系列答案
相关题目
2-氯丙烷跟氢氧化钠的醇溶液共热后,生成的产物再与溴水反应,得到的产物的同分异构体有( )
| A、2种 | B、4种 | C、3种 | D、5种 |
下列说法错误的是( )
| A、已知2NO2?N2O4加压后颜色先变深后变浅 |
| B、在密闭容中发生下列反应aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,故可知A的转化率变小 |
| C、在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Z的浓度有可能是0.4 mol/L |
| D、未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是⑤⑥⑦⑧. ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能 |
造成硫酸型酸雨的主要物质是( )
| A、NO2 |
| B、SO2 |
| C、CF2Cl2 |
| D、CO |
现在在公路上经常能看到一些油罐车,这些车上应该贴的图标是( )
A、 |
B、 |
C、 |
D、 |