题目内容
1.某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②纯碱和熟石灰都是碱;③冰和干冰都既是纯净物又是化合物;④盐酸和食醋既是化合物又是酸;⑤豆浆和雾都是胶体.上述说法正确的是( )| A. | ①②③ | B. | ①②⑤ | C. | ③④⑤ | D. | ①③⑤ |
分析 ①由两种或两种以上的物质组成,则属于混合物;
②水溶液中电离出的阴离子全部是氢氧根离子的化合物为碱,纯碱是碳酸钠;
③同种物质组成的为纯净物,不同元素组成的纯净物为化合物,冰是水,干冰为固体二氧化碳;
④酸是水溶液中电离出的阳离子全部是氢离子的化合物,盐酸和食醋都是溶液,是混合物;
⑤分散质微粒直径1nm-100nm形成的分散系为胶体,豆浆和雾形成的分散系是胶体.
解答 解:①粗盐和酸雨都是由两种或两种以上的物质组成,则属于混合物,故①正确;
②纯碱是碳酸钠,是由金属离子和酸根离子构成,属于盐,故②错误;
③冰是水,干冰为固体二氧化碳,都是由两种元素组成的纯净物,则属于化合物,故③正确;
④盐酸和食醋都是溶液,属于化合物,它们中的溶质HCl和CH3COOH都是化合物,二者属于酸,故④错误;
⑤豆浆和雾形成的分散系是胶体,故⑤正确;
故选D.
点评 本题考查常见物质的分类,明确物质的组成、构成以及分类标准即可解答,并注意物质的俗名、能源等知识来解,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列叙述错误的是( )
| A. | 把a L0.1mol•L-1的CH3COOH溶液与bL 0.1mol•L-1的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 把0.1mol•L-1的NaHCO3溶液与0.3mol•L-1的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba2+)>c(Na+)>c(H+) | |
| C. | 向1mol•L-1的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| D. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
12.结合图盘算,下列叙述正确的是( )
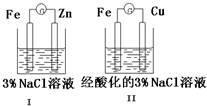

| A. | Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-═4OH- | |
| B. | Ⅰ和Ⅱ中负极反应均是Fe-2e-═Fe2+ | |
| C. | Ⅰ和Ⅱ中正极均被保护 | |
| D. | Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀产生 |
9.下列现象或事实能用同一原理解释的是( )
| A. | SO2和FeSO4溶液使酸性高锰酸钾的紫色退去 | |
| B. | Cl2和SO2都能使品红溶液褪色 | |
| C. | 常温下铁和金都不溶于浓硝酸 | |
| D. | 漂白粉和水玻璃长期暴露会变质 |
6.能用H++OH-═H2O来表示的化学反应是( )
| A. | NaOH溶液与醋酸反应 | B. | KOH溶液与稀盐酸反应 | ||
| C. | Ba(OH)2溶液与稀硫酸反应 | D. | Cu(OH)2与稀硝酸反应 |
13.某有机物分子式为C8H8O2,其中能与NaOH溶液反应且分子中含有苯环的同分异构体数目为( )
| A. | 9种 | B. | 16种 | C. | 20种 | D. | 29种 |
10.标准状况下,100mL稀硝酸与足量金属锌完全反应生成336mL N0和NO2,向混合气体中加入336mL NH3,在一定条件下恰好使其完全转化为N2.若用一定浓度的氢氧化钠溶液进行吸收处理(反应方程式:2NO2+2Na0H═NaNO3+NaNO2+H20;NO2+N0+2Na0H═2NaNO2+H20),则消耗氢氧化钠溶液的体积为150mL,下列说法正确的是( )
| A. | 混合气体中N0的物质的量为0.01mol | |
| B. | 混合气体中N02的物质的量为0.02mol | |
| C. | 稀硝酸的浓度为0.045mol/L | |
| D. | 氢氧化钠溶液的浓度为0.1mol/L |
15.以石墨为电极,电解KI溶液(含有少量的酚酞和淀粉),下列说法正确的是( )
| A. | 阳极附近溶液呈红色 | B. | 阳极逸出气体 | ||
| C. | 阴极附近溶液呈蓝色 | D. | 溶液的PH变大 |
