题目内容
16.浓硫酸具有:①酸性 ②强氧化性 ③吸水性 ④脱水性,下列现象硫酸所表现出的性质为(填编号)干燥氧气③,使蔗糖变黑④,吸收氨气①,与铜反应①和②.分析 浓硫酸具有吸水性,用于干燥氧气,浓硫酸滴到蔗糖上,蔗糖变黑,纸中H、O以水的形式脱出,氨气是碱性气体,与浓硫酸反应生成铵盐,浓硫酸与铜反应生成二氧化硫体现硫酸的强氧化性,生成硫酸铜体现硫酸的酸性,由此分析解答.
解答 解:干燥氧气体现吸水性,使蔗糖变黑体现浓硫酸的脱水性,吸收氨气体现硫酸的酸性,与铜反应体现浓硫酸的酸性和强氧化性,故答案为:③;④;①;①和②.
点评 本题考查了物质的性质,熟悉浓硫酸的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
7.下列物质不能由两种单质直接化合得到的是( )
| A. | Fe3O4 | B. | Na2O2 | C. | NO | D. | FeCl2 |
8.将含有Fe2O3、SiO2杂质的Al2O3样品提纯,其流程示意图如图:下列说法错误的是( )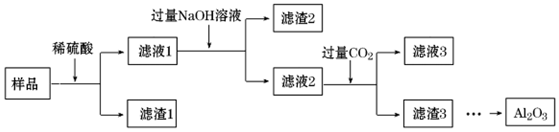

| A. | 滤渣1 的主要成分为SiO2 | |
| B. | 可用KSCN溶液检验滤液1中的Fe 3+ | |
| C. | 滤液2为纯净的Na AlO2溶液 | |
| D. | 将滤渣3 洗涤、干燥、灼烧,可以得到Al2O3 |
4.下列条件下,两瓶气体所含原子数一定相等的是( )
| A. | 同压强、同体积的N2O和CO2 | B. | 同体积、同密度的C2H4和C3H6 | ||
| C. | 同温度、同体积的H2和N2 | D. | 同体积、不同密度的N2和CO |
8.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+→2Fe3++2H2O①2Fe3++H2O2→2Fe2++O2↑+2H+②下列说法错误的是( )
| A. | 由方程式①可知,H2O2的氧化性比Fe3+强 | |
| B. | 在H2O2分解过程中,溶液的H+的物质的量逐渐上升 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
5.往水中加入下列物质,对水的电离平衡不产生影响的是( )
| A. | NaHSO4 | B. | CH3COOK | C. | KAl(SO4)2 | D. | NaI |
6.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | Fe$→_{高温}^{Al_{2}O_{3}}$Al$\stackrel{NaOH(aq)}{→}$H2 | |
| B. | MgCl2•6H2O$→_{△}^{HCl}$MgCl2$\stackrel{熔融电解}{→}$Mg | |
| C. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{NaOH(aq)}{→}$NaNO2 | |
| D. | SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO3(s)$\stackrel{O_{2}}{→}$BaSO4(s) |
 图中表示A~E五种物质的转化关系.若将它们灼烧,火焰都呈黄色;A能跟水起剧烈反应,D常用作潜水艇里的氧气来源.试推断A~E各物质(写化学式):
图中表示A~E五种物质的转化关系.若将它们灼烧,火焰都呈黄色;A能跟水起剧烈反应,D常用作潜水艇里的氧气来源.试推断A~E各物质(写化学式):