��Ŀ����
11��������N2H4��������������һ����Ҫ�Ļ��ȼ�ϣ�N2H4��N2O4��Ӧ�ܷų��������ȣ���1����֪��2NO2��g�� N2O4��g����H=-57.20 mol•L-1��һ���¶��£����ܱ������з�Ӧ2NO2��g�� N2O4��g���ﵽƽ�⣮ ������������ʱ�����д�ʩ�����NO2ת���ʵ���BC������ĸ��
A������ϡ������Ar B�������¶� C������NO2��Ũ�� D���������
��2��25��ʱ��1.00 g Һ̬N2H4������N2O4������ȫ��Ӧ����N2��H2O���ų�19.14 kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ2N2H4��l��+N2O4��l���T3N2��g��+4H2O��l����H=-1224.96KJ/mol��
��3��17�桢1.01��105Pa���ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ��c��NO2��=0.0300 mol•L-1��c��N2O4��=0.0120 mol•L-1�����㷴Ӧ2NO2��g��?N2O4��g����ƽ�ⳣ��K��
��4������һ������Cu��������ŨHNO3��Ӧ���Ƶ�1.00 L�Ѵﵽƽ���N2O4��NO2�Ļ�����壨17�桢1.01��105 Pa��������������������Cu���ٿˣ�
���� ��1���÷�Ӧ�Ƿ�Ӧǰ�����������С�ġ����ȵĿ��淴Ӧ��Ҫ��߶���������ת���ʣ�ֻҪ�ı�����ʹ��ѧƽ��������Ӧ�����ƶ����ɣ�
��2������������ݼ���2mol����ȫȼ�շ��ȣ�����Ȼ�ѧ����ʽ��д������ע���ʾۼ�״̬���Ͷ�Ӧ�ʱ������
��3������ƽ�ⳣ������ʽk=$\frac{c��{N}_{2}{O}_{4}��}{{c}^{2}��N{O}_{2}��}$�����㣻
��4������N2O4��NO2�����ʵ��������ݵ���ת�Ƽ���Cu�����ʵ���������m=nM����Cu��������
��� �⣺��1���÷�Ӧ�Ƿ�Ӧǰ�����������С�ġ����ȵĿ��淴Ӧ��Ҫʹ�÷�Ӧ������Ӧ�����ƶ����ɸı䷴Ӧ���Ũ�ȡ���ϵ��ѹǿ���¶ȵȣ�
A�����������г���ϡ������Ar����ѹ�����ѹ���䣬ƽ�ⲻ�䣬ת���ʲ��䣬��A����
B�������¶ȣ�ƽ��������Ӧ�����ƶ���N02��ת������ߣ���B��ȷ��
C������N02��Ũ�ȣ�ƽ��������Ӧ�����ƶ�������ϵѹǿ����Ҳ���ڷ�Ӧ������Ӧ�����ƶ�����C��ȷ��
D�������¶ȣ�ƽ�����淴Ӧ�����ƶ���N02��ת���ʽ��ͣ���D����
�ʴ�Ϊ��BC��
��2��1.00gN2H4��l��������N2O4��l����ȫ��Ӧ����N2��g����H2O��l�����ų�19.14kJ����������2molN2O4��l��������Ϊ2mol��32g/mol=64g���ų�����Ϊ19.14kJ��64=1224.96KJ����������Ӧ���Ȼ�ѧ����ʽΪ��2N2H4��l��+N2O4��l���T3N2��g��+4H2O��l����H=-1224.96KJ/mol��
�ʴ�Ϊ��2N2H4��l��+N2O4��l���T3N2��g��+4H2O��l����H=-1224.96KJ/mol��
��3��ƽ��ʱ��c��NO2��=0.030 0mol•L-1��c��N2O4��=0.012 0mol•L-1����Ӧ2NO2��g?N2O4��g����ƽ�ⳣ��k=$\frac{c��{N}_{2}{O}_{4}��}{{c}^{2}��N{O}_{2}��}$=$\frac{0.012}{0.0{3}^{2}}$=13.3��
�𣺸��¶��£��÷�Ӧ��ƽ�ⳣ��Ϊ13.3��
��4���ɣ�3����֪����17�桢1.01��105Pa�ﵽƽ��ʱ��1.00 L��������У�
n��N2O4��=c��N2O4����V=0.0120 mol•L-1��1.00L=0.0120mol
n��NO2��=c��NO2����V=0.0300 mol•L-1��1.00L=0.0300mol
�� n ��NO2����=n��NO2��+2n��N2O4��=0.0540mol
��Cu+4HNO3=Cu��NO3��2+2NO2��+2H2O�ɵ�
m=$\frac{0.0540mol}{2}$=1.73g��
��������Cu������Ϊ1.73g��
���� ���⿼�黯ѧƽ����㡢��Ӧ�ȼ��㡢Ӱ�컯ѧƽ�����ط����жϣ�ע�����õ���ת���غ���㣬���ջ����ǽ���ؼ����Ѷ��еȣ�

 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�| A�� | ���������������������ֱ�����������ȫȼ�գ����߷ų��������� | |
| B�� | 1molH2��������������ȫȼ�����ų�����������H2��ȼ���� | |
| C�� | ������NaOH��Һ��Ӧ���к��ȡ�H=-57.3kJ•mol-1���������Ca��OH��2��Һ��Ӧ���к��ȡ�H=-2��57.3kJ•mol-1 | |
| D�� | һ�������£�0.1molN2��g����0.3molH2��g����ϳ�ַ�Ӧʱ�ų�������Ϊ8kJ������N2��g��+3H2��g��?2NH3��g����H=-80kJ•mol-1 |
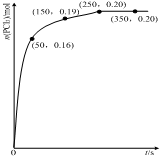 �¶�ΪTʱ����2.0L�����ܱ������г���1.0mol PCl5����ӦPCl5��g�� PCl3��g��+Cl2��g������һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ��n��PCl3����ʱ��ı仯��ͼ������˵����ȷ���ǣ�������
�¶�ΪTʱ����2.0L�����ܱ������г���1.0mol PCl5����ӦPCl5��g�� PCl3��g��+Cl2��g������һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ��n��PCl3����ʱ��ı仯��ͼ������˵����ȷ���ǣ�������| A�� | ��Ӧ��ǰ50 s ��ƽ������v��PCl5��=0.0032 mol•L-1•s-1 | |
| B�� | �÷�Ӧ��ƽ�ⳣ��K=0.025 | |
| C�� | ��ͬ�¶��£���ʼʱ�������г���1.0 mol PCl5��0.20molPCl3 ��0.20 mol Cl2����Ӧ�ﵽƽ��ǰv��������v���棩 | |
| D�� | ���������������䣬�����¶ȣ�ƽ��ʱ��c��PCl3��=0.11mol•L-1����Ӧ�ġ�H��0 |
| A�� | ��ϩ�ܷ����ӳɷ�Ӧ�������鲻�ܷ����ӳɷ�Ӧ | |
| B�� | �һ����ǻ���Ӱ�죬ʹ�ǻ��Ļ��Ա���������H+����������H2O | |
| C�� | �ױ���ʹ���Ը��������Һ��ɫ����������ʹ���Ը��������Һ��ɫ | |
| D�� | �ױ��������������õõ�һ����ȡ����ķ�Ӧ�����ֱ�Ϊ30�桢50-60�� |
 ��Ч�ؿ�������̼��Դ���ʵ������ԴΣ�������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʣ�
��Ч�ؿ�������̼��Դ���ʵ������ԴΣ�������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʣ�