��Ŀ����
3��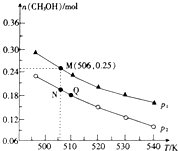 ������̼�dz������������壬����������ǻ��������о����ȵ���⣮�ش��������⣺
������̼�dz������������壬����������ǻ��������о����ȵ���⣮�ش��������⣺��1��Li4SiO4�����ڸ���CO2��ԭ������500�棬��Ũ��CO2��Li4SiO4�Ӵ�������������Σ�ƽ��������700�棬��Ӧ������У��ų���Ũ��CO2��Li4SiO4������700��ʱ��Ӧ�Ļ�ѧ����ʽΪLi2CO3+Li2SiO3?CO2+Li4SiO4��
��2��C02����ϳɵ�̼ϩ���ļ����ڽ��ܼ��ŵȷ��������Ҫ���壮�Ժϳ�C2H4Ϊ������ת����Ϊ�������У�
��һ����CO2��g��+H2��g��?CO��g��+H2O��g����H=+41.3kJ/mol-1
�ڶ�����2CO��g��+4H2��g��?C2H4��g��+2H2O��g����H=-210.5kJ/mol-1
��CO2����ϳ���ϩ���Ȼ�ѧ����ʽΪ2CO2+6H2��g��?C2H4��g��+4H2O��g����H=-127.9 kJ/mol��
��һ�������µ��ܱ������У��ܷ�Ӧ�ﵽƽ�⣬Ҫ���CO2��ת���ʣ����Բ�ȡ�Ĵ�ʩ��bd������ĸ����
A����Сѹǿ B������H2Ũ�� C�������ʵ����� D�������H2O��g��
��3����CO2��H2�ϳ�CH3OH�ķ�Ӧ���£�CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H����10L�ĺ��ܱ�������Ͷ��1molCO2��2.75molH2���ڲ�ͬ�����·���������Ӧ�����ƽ��ʱ�״������ʵ������¶ȡ�ѹǿ�ı仯��ͼ��ʾ��
��������Ӧ�ġ�H���������������0���ж�������ѹǿһ��ʱ���¶�Խ�ߣ�CH3OH�����ʵ���ԽС��˵�������¶�ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��
��ͼ��ѹǿP1���������������P2��
�۾��ⶨ֪Q��ʱ������ѹǿ�Ƿ�Ӧǰѹǿ��$\frac{9}{10}$������Ӧ�ӿ�ʼ��ƽ�������ʱ��Ϊ5min���t0〜5min��H2ζ�ķ�Ӧ����v��H2��=1.125��10-2mol/��L•min����
��N��ʱ���÷�Ӧ��ƽ�ⳣ��K=1.04������������2λС������
���� ��1�����������Ϣ����Ӧ��ΪCO2��Li4SiO4����������Li2CO3�����������غ���н��
��2������֪����CO2��g��+H2��g��?CO��g��+H2O��g����H=+41.3kJ/mol
��2CO��g��+4H2��g��?C2H4��g��+2H2O��g����H=-210.5kJ/mol
���ݸ�˹���ɣ����2+��ɵã�2CO2+6H2��g��=C2H4��g��+4H2O��g����
��Ҫ���CO2��ת���ʣ��ı�����Ӧʹƽ�������ƶ���������ֻ���������̼������������ת����Ϊ���ͣ����ƽ���ƶ�ԭ���������
��3������ͼ��֪��ѹǿһ��ʱ���¶�Խ�ߣ�CH3OH�����ʵ���ԽС��˵�������¶�ƽ�����淴Ӧ�����ƶ���
������ӦΪ���������С�ķ�Ӧ���¶�һ��ʱ������ѹǿ��ƽ��������Ӧ�����ƶ����״������ʵ�������
���ɷ�Ӧǰ��ѹǿ�ı仯�Լ����ʵļ��㹫ʽ�����Ƴ�0-5min�ڵķ�Ӧ���ʣ�
��ͼ��M��ʱ���������Ϊ10L�����M��������֪��M���CH3OH�����ʵ���Ϊ0.25mol��
���ݷ�ӦCO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ��mol/L�� 0.1 0.275 0 0
ת����mol/L��0.025 0.075 0.025 0.025
ƽ�⣨mol/L�� 0.075 0.2 0.025 0.025
����K=$\frac{c��H2O��•c��CH3OH��}{c3��H2��•c��CO2��}$���㣬�¶Ȳ���ƽ�ⳣ�����䣮
��� �⣺��1����500�棬CO2��Li4SiO4�Ӵ�������Li2CO3����Ӧ��ΪCO2��Li4SiO4����������Li2CO3�����������غ��֪���ﻹ��Li2SiO3������700��ʱ��Ӧ�Ļ�ѧ����ʽΪ��Li2CO3+Li2SiO3?CO2+Li4SiO4���ʴ�Ϊ��Li2CO3+Li2SiO3?CO2+Li4SiO4��
��2������֪����CO2��g��+H2��g��?CO��g��+H2O��g����H=+41.3kJ/mol
��2CO��g��+4H2��g��?C2H4��g��+2H2O��g����H=-210.5kJ/mol
���ݸ�˹���ɣ����2+��ɵã�2CO2+6H2��g��=C2H4��g��+4H2O��g����H=-127.9 kJ/mol��
�ʴ�Ϊ��2CO2+6H2��g��?C2H4��g��+4H2O��g����H=-127.9 kJ/mol��
��a������ӦΪ���������С�ķ�Ӧ����ѹ�����������С��CO2��ת���ʼ�С����a����
b������H2Ũ�ȣ�ƽ�������ƶ���CO2��ת��������b��ȷ��
c�������ʵ����������Լӿ췴Ӧ���ʣ�����Ӱ��ƽ���ƶ���CO2��ת���ʲ��䣬��c����
d�������ˮ��������Ũ�ȼ�С��ƽ�������ƶ���CO2��ת��������d��ȷ��
��ѡ��bd��
��3������ͼ��֪��ѹǿһ��ʱ���¶�Խ�ߣ�CH3OH�����ʵ���ԽС��˵�������¶�ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�ѹǿһ��ʱ���¶�Խ�ߣ�CH3OH�����ʵ���ԽС��˵�������¶�ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��
������ӦΪ���������С�ķ�Ӧ���¶�һ��ʱ������ѹǿ��ƽ��������Ӧ�����ƶ����״������ʵ�������ѹǿP1��P2���ʴ�Ϊ������
�۸��ݷ�Ӧ CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ��mol/L�� 0.1 0.275 0 0
ת����mol/L��x 3x x x
ƽ�⣨mol/L��0.1-x 0.275-3x x x
����ѹǿΪ��Ӧǰ��$\frac{9}{10}$�����г�����ʽ$\frac{0.1-x+0.275-3x+x+x}{0.1+0.275}$=$\frac{9}{10}$�����Լ����x=0.01875��
V��H2��=$\frac{��{C}_{��H2��}}{��t}$=$\frac{3��0.01875mol/l}{5min}$=1.125��10-2mol/��L•min���ʴ�Ϊ1.125��10-2mol/��L•min����
���¶Ȳ���ƽ�ⳣ�����䣬ͼ��M��ʱ���������Ϊ10L�����M��������֪��M���CH3OH�����ʵ���Ϊ0.25mol��
���ݷ�Ӧ CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ��mol/L�� 0.1 0.275 0 0
ת����mol/L��0.025 0.075 0.025 0.025
ƽ�⣨mol/L�� 0.075 0.2 0.025 0.025
K=$\frac{c��H2O��•c��CH3OH��}{c3��H2��•c��CO2��}$=$\frac{0.025��0.025}{0��{2}^{3}��0.075}$=1.04��
�ʴ�Ϊ��1.04��
���� ���⿼�黯ѧƽ��Ӱ�����ء�ƽ�ⳣ������˹����Ӧ�õȣ�ע��Ի���֪ʶ���������գ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | c��Na+����c��S2-��=1��1 | B�� | c��Na+����c��S2-����2��1 | C�� | c��Na+����c��S2-��=2��1 | D�� | c��Na+������c��S2-����2��1 |
| A�� | CnH2n | B�� | CnH2n+2 | C�� | CnH2n-2 | D�� | CnH2n-6 |
| A�� | $\frac{m}{28}$ | B�� | m | C�� | $\frac{m}{14}$ | D�� | 28m |
| A�� | ��������� | B�� | ���� | C�� | ���� | D�� | ������̼ |
��TiO2+2C+2Cl2 $\frac{\underline{\;\;��\;\;}}{\;}$ TiCl4��+2CO������TiCl4+2Mg $\frac{\underline{\;\;��\;\;}}{\;}$2MgCl2+Ti��
���й�����������Ӧ��������ȷ���ǣ�������
| A�� | �������û���Ӧ | B�� | ��Ӧ����̼�������� | ||
| C�� | ���ڷ�Ӧ�о�����ԭ | D�� | ��Ӧ��˵��������þ������ |

| A�� | ����һ�ȴ���ֻ��һ��ͬ���칹�� | |
| B�� | ���Ķ��ȴ���������ͬ���칹�� | |
| C�� | ����ʹ��ˮ��ɫ | |
| D�� | ���뱽��ϩ��C6H5-CH=CH2����Ϊͬ���칹�� |
| A�� | Al��OH��3 | B�� | Fe��OH��3 | C�� | Na2CO3 | D�� | AlCl3 |