题目内容
8.设NA表示阿伏加德罗常数值,下列叙述中正确的是( )| A. | 电解食盐水若产生2g氢气,则转移的电子数目为NA | |
| B. | 电解精炼铜时转移0.1 NA个电子,则阳极溶解3.2g铜 | |
| C. | VL amol/L FeCl3 溶液中,若Fe3+数目为NA,则Cl-的数目大于3NA | |
| D. | 100mL 1mol/L的醋酸溶液中,CH3COO-离子数为0.1NA |
分析 A.依据电解饱和食盐水电解反应和电子守恒计算分析;
B.粗铜中含有杂质铁、锌等活泼金属,电解过程中优先放电,所以阳极溶解的铜减少;
C.铁离子在溶液中发生水解,导致铁离子数目减少,氯离子的数目大于铁离子数目的3倍;
D.醋酸为弱电解质,溶液中只能部分电离出醋酸根离子;
解答 解:A.电解食盐水若产生2g氢气,物质的量=$\frac{2g}{2g/mol}$=1mol,电解反应为2H++2e-=H2↑,则转移的电子数目为2NA,故A错误;
B.电解精炼铜时转移0.1NA个电子,转移了0.1mol电子,由于粗铜中杂质铁、锌优先放电,所以阳极减少的铜的物质的量小于0.05mol,减少的质量小于3.2g,故B错误;
C.VL a mol/L FeCl3溶液中,铁离子部分水解,溶液中铁离子数目减少,若Fe3+数目为NA,则Cl-的数目大于3NA,故C正确;
D.100mL 1mol/L的醋酸溶液中含有溶质醋酸0.1mol,醋酸为弱电解质,0.1mol醋酸电离出的醋酸根离子小于0.1mol,所以溶液中CH3COO-离子数小于0.1NA,故D错误;\
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项B为易错点,注意粗铜中含有活泼性较强的铁、锌等杂质;试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,下列说法不正确的是( )
①铅蓄电池在放电过程中,负极质量减小,正极质量增加
②铅蓄电池是一种无污染的电池
③该电池工作时,正极附近溶液的pH增大
④使用该电池时,若外电路上转移电子0.05mol,则消耗H2SO4的物质的量为0.05mol.
①铅蓄电池在放电过程中,负极质量减小,正极质量增加
②铅蓄电池是一种无污染的电池
③该电池工作时,正极附近溶液的pH增大
④使用该电池时,若外电路上转移电子0.05mol,则消耗H2SO4的物质的量为0.05mol.
| A. | ①②③④ | B. | ①②④ | C. | ①② | D. | ③④ |
19.有aXn-和bYm+两种单原子离子,它们的电子层结构相同,下列关系式或化学式不正确是( )
| A. | a+n=b-m | B. | X的氢化物化学式为HnX或XHn | ||
| C. | a<b | D. | Y的氧化物化学式为YOm |
16.工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)?CH3OH(g)△H
(1)判断反应达到平衡状态的依据是(填字母序号,下同)CD.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)如表所列数据是反应在不同温度下的化学平衡常数(K).
①由表中数据判断△H<(填“>”、“=”或“<”)0;
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃.
(3)要提高CO的转化率,可以采取的措施是DF.
A.升温 B.加入催化剂
C.增加CO的浓度 D.加入H2加压
E.加入惰性气体加压 F.分离出甲醇
(4)300℃时,在一定的压强下,5mol CO与足量的H2在催化剂的作用下恰好完全反应变化的热量为454kJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
下列说法正确的是D.
A.2c1>c3 B.a+b<90.8
C.2p2<p3 D.α1+α3<1.
CO(g)+2H2(g)?CH3OH(g)△H
(1)判断反应达到平衡状态的依据是(填字母序号,下同)CD.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)如表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃.
(3)要提高CO的转化率,可以采取的措施是DF.
A.升温 B.加入催化剂
C.增加CO的浓度 D.加入H2加压
E.加入惰性气体加压 F.分离出甲醇
(4)300℃时,在一定的压强下,5mol CO与足量的H2在催化剂的作用下恰好完全反应变化的热量为454kJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1mol CO、2mol H2 | 1mo l CH3OH | 2mol CH3OH | |
| 平衡时数据 | CH3OH的 浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
A.2c1>c3 B.a+b<90.8
C.2p2<p3 D.α1+α3<1.
3.下列关于NO和NO2的叙述正确的是( )
| A. | NO是一种红棕色气体 | |
| B. | NO2与水反应生成硝酸,所以NO2是硝酸的酸酐 | |
| C. | NO和NO2是引发光化学烟雾的主要污染源 | |
| D. | NO2可用排水法收集 |
13.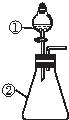 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选項 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 氢氧化钠稀溶液 | 硫酸铝铵溶液 | 立即产生白色沉淀 |
| B | 氢氧化钠浓溶液 | 用砂纸打磨过的镁条 | 立即产生大量无色气体 |
| C | 浓硫酸 | 铜粉 | 立即产生刺激性气味气体 |
| D | 盐酸 | 较浓的硝酸亚铁溶液 | 无明显现象 |
| A. | A | B. | B | C. | C | D. | D |
18.下列仪器中没有“0”刻度线的是( )
| A. | 托盘天平的游码刻度尺 | B. | 温度计 | ||
| C. | 酸式滴定管 | D. | 量筒 |
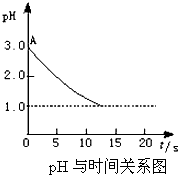 某课题小组的同学对“电解氯化铜溶液时的pH变化”的问题,有以下两种不同的观点:
某课题小组的同学对“电解氯化铜溶液时的pH变化”的问题,有以下两种不同的观点: