题目内容
18.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,下列说法不正确的是( )①铅蓄电池在放电过程中,负极质量减小,正极质量增加
②铅蓄电池是一种无污染的电池
③该电池工作时,正极附近溶液的pH增大
④使用该电池时,若外电路上转移电子0.05mol,则消耗H2SO4的物质的量为0.05mol.
| A. | ①②③④ | B. | ①②④ | C. | ①② | D. | ③④ |
分析 根据放电时的电池反应PbO2+Pb+2H2SO4═2PbSO4+2H2O可知,Pb在反应中失去电子,为电池的负极,PbO2在放电过程中得到电子被还原,所以它是原电池的正极;原电池放电的过程中消耗硫酸,所以溶液的酸性减弱,据此进行解答.
解答 解:①铅蓄电池在放电过程中,Pb作负极,在反应中失去电子生成PbSO4,反应式为:Pb+SO42--2e-═PbSO4,硫酸铅是固体,负极质量增重,正极电极反应式为PbO2+4H++SO42-+2e-═PbSO4+2H2O,正极质量增加,故①错误;
②铅蓄电池中含有重金属铅,对环境有污染,不属于绿色环保电池,故②错误;
③正极电极反应式为PbO2+4H++SO42-+2e-═PbSO4+2H2O,放电的过程中消耗硫酸,电解质溶液中氢离子浓度逐渐减小,所以溶液的酸性减弱,溶液pH增大,故③正确;
④根据总反应式中的关系:2H2SO4~2e-,外电路上转移电子0.05mol,则消耗H2SO4的物质的量也为0.05mol,故④正确;
故选C.
点评 本题考查了常见的化学电源及工作原理,题目难度中等,注意掌握常见化学电源的类型及工作原理,能够根据原电池总反应判断两极,并能够正确书写电极反应式.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
8.下列关于苯的性质的叙述不正确的是( )
| A. | 苯是无色、带有特殊气味的液体 | |
| B. | 常温下苯是一种不溶于水且密度小于水的液体 | |
| C. | 苯分子中6个碳碳化学键完全相同 | |
| D. | 苯中含有碳碳双键,所以苯属于烯烃 |
9.下列变化中生成物的总能置大于反应物的总能量的是( )
| A. | 镁与稀盐酸反应 | B. | 一氯化碳的燃烧 | ||
| C. | 氢氧化钡晶体与氯化铵晶体反应 | D. | 氧化钙与水反应 |
6.苯在燃烧时不可能生成的是( )
| A. | 二氧化碳 | B. | 水 | C. | 氯化氢 | D. | 一氧化碳 |
7.砹(At)是原子序数最大的卤族元素,推测砹和砹的化合物最不可能具有的性质是( )
| A. | 砹化氢(HAt)很稳定 | B. | 单质砹易溶于某些有机溶剂 | ||
| C. | 砹的原子半径比碘的原子半径大 | D. | 单质砹是有色固体 |
8.设NA表示阿伏加德罗常数值,下列叙述中正确的是( )
| A. | 电解食盐水若产生2g氢气,则转移的电子数目为NA | |
| B. | 电解精炼铜时转移0.1 NA个电子,则阳极溶解3.2g铜 | |
| C. | VL amol/L FeCl3 溶液中,若Fe3+数目为NA,则Cl-的数目大于3NA | |
| D. | 100mL 1mol/L的醋酸溶液中,CH3COO-离子数为0.1NA |


 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
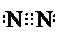 .
.