题目内容
18.关于氢键,下列说法正确的是( )| A. | 由于冰中的水分子间存在氢键,所以其密度大于液态水 | |
| B. | 可以用氢键解释接近沸点的水蒸气的相对分子质量测定值比用化学式(H2O)计算出来的相对分子质量大 | |
| C. | 分子间氢键和分子内氢键都会使熔沸点升高 | |
| D. | 每一个水分子内平均含有两个氢键 |
分析 A.水分子由于之间的氢键,内部是以一个水分子为中心,四个水分子将其抱住,呈现正四面体的空间结构,即缔合成的水分子团是(H2O)5,由于正四面体是一个立体结构,形如网状结构,内部有较大的空间没有被水分子占据,空间利用率很低,所以冰中的水分子间的间隙较大,排列的较松散,使得总体积比液态水大,所以其密度小于液态水;
B.水分子间存在氢键,形成缔合分子;
C.分子间氢键使分子形成缔合分子,分子间作用力变大;
D.一个水分子形成3个氢键.
解答 解:A.水分子由于之间的氢键,内部是以一个水分子为中心,四个水分子将其抱住,呈现正四面体的空间结构,即缔合成的水分子团是(H2O)5,由于正四面体是一个立体结构,形如网状结构,内部有较大的空间没有被水分子占据,空间利用率很低,所以冰中的水分子间的间隙较大,排列的较松散,使得总体积比液态水大,所以其密度小于液态水,故A错误;
B.水分子间存在氢键,形成缔合分子,通常测定水的相对分子质量为缔合分子的相对分子质量,所以相对分子质量大于理论值,故B正确;
C.分子间氢键使分子形成缔合分子,分子间作用力变大,所以分子间氢键使熔沸点升高,而分子内氢键会使熔沸点降低,故C错误;
D.水分子中的2个H原子与另外两个水分子形成2个氢键,O原子与另一个水分子中的H原子也形成氢键,所以一个水分子形成3个氢键,故D错误.
故B.
点评 本题考查氢键与化学键、氢键与物质的性质,明确氢键只影响物质的物理性质是解答本题的关键,题目难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列物质中不属于高分子化合物的是( )
| A. | 蛋白质 | B. | 硝酸甘油脂 | C. | 硝酸纤维素脂 | D. | 天然橡胶 |
3.既能跟盐酸反应又能跟氢氧化钠溶液反应的化合物是( )
| A. | AlCl3 | B. | Al(OH)3 | C. | Na2CO3 | D. | Al |
10.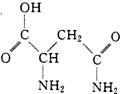 芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
(1)天冬酰胺所含元素中,氮(填元素名称)元素基态原子核外未成对电子数最多.
(2)天冬酰胺中碳原子的杂化轨道类型有sp3、sp2.
(3)H2Se的晶体类型为分子晶体,含有的共价键类型为极性共价键.
(4)已知钼(Mo)位于第五周期、ⅥB族,钼、铬、锰的部分电离能如表所示:
A是Mn(填元素符号),B原子的价电子排布式为3d54s1.
 芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.(1)天冬酰胺所含元素中,氮(填元素名称)元素基态原子核外未成对电子数最多.
(2)天冬酰胺中碳原子的杂化轨道类型有sp3、sp2.
(3)H2Se的晶体类型为分子晶体,含有的共价键类型为极性共价键.
(4)已知钼(Mo)位于第五周期、ⅥB族,钼、铬、锰的部分电离能如表所示:
| 编号 | I5/kJ•mol-1 | I6/kJ•mol-1 | I7/kJ•mol-1 | I8/kJ•mol-1 |
| A | 6990 | 9220 | 11500 | 18700 |
| B | 6702 | 8745 | 15455 | 17820 |
| C | 5257 | 6641 | 12125 | 13860 |
7.下列各组微粒具有相同质子数和电子数的是( )
| A. | CH4,NH3,H2O,Ne | B. | OH-,NH4+,H3O+,Ne | ||
| C. | H3O+,NH4+,Na+,HF | D. | OH-,F-,Mg2+,Na+ |
8.现有C2H2、CH3CHO、C6H6三种蒸汽的混合物,已知含O量为8%,则C的含量为( )
| A. | 84% | B. | 60% | C. | 91% | D. | 42% |

 、B
、B .
. +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$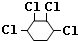 .
.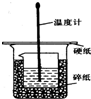 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题: