题目内容
3.在等质量的下列物质中:CO2,HCl,O2,NH3其中常温常压下密度最小的是NH3;所含分子数目最少的是CO2;在标准状况下体积最大的是NH3;在标准状况下体积最小的是CO2.分析 同温同压下,气体摩尔体积相同,根据ρ=$\frac{M}{Vm}$知,密度与气体摩尔质量成正比;根据N=$\frac{m}{M}$NA知,相同质量时,分子数和摩尔质量成反比;根据分子数和每个分子中含有的原子个数判断;根据V=$\frac{m}{M}$Vm知,相同质量、相同气体摩尔体积时,气体体积与摩尔质量成反比.
解答 解:二氧化碳的摩尔质量是44g/mol,氯化氢的摩尔质量是36.5g/mol,氧气的摩尔质量是32g/mol,氨气的摩尔质量是17g/mol,
同温同压下,气体摩尔体积相同,根据ρ=$\frac{M}{Vm}$知,密度与气体摩尔质量成正比,所以气体密度最小的是NH3;
根据N=$\frac{m}{M}$NA知,相同质量时,分子数和摩尔质量成反比,所以分子数最少的是CO2;
根据分子数和每个分子中含有的原子个数判断,已知含有分子数最多的是氨气分子,最少的在二氧化碳分子,一个二氧化碳分子中含有3个原子,一个氯化氢分子中含有2个原子,一个水分子中含有3个原子,一个氨气分子中含有4个原子,所以含有原子个数最多的是NH3;根据V=$\frac{m}{M}$Vm知,相同质量、相同气体摩尔体积时,气体体积与摩尔质量成反比,所以体积最大的是NH3,二氧化碳的体积最小,
故答案为:NH3;CO2;NH3;CO2.
点评 本题考查了阿伏伽德罗定律的推论,明确基本公式及使用条件是解本题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( )
| A. | 干燥的 | B. | 瓶塞不漏水的 | ||
| C. | 用待配溶液洗涤过的 | D. | 以上三项都符合的 |
15.下列各组物质的转化关系中,都能通过一步反应实现的是( )
| A. | Na→NaOH→NaHCO3→NaCl | B. | Al→Al2O3→Al(OH)3→AlCl3 | ||
| C. | Fe→Fe(OH)2→FeCl2→FeCl3 | D. | Si→SiO2→H2SiO3→Na2SiO3 |
12.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )
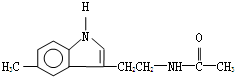

| A. | 其官能团和营养成分与葡萄糖相同 | |
| B. | 其分子式为C13H15N2O | |
| C. | 该物质不能与溴的四氯化碳溶液反应 | |
| D. | 该物质能发生水解反应并生成乙酸 |
13.已知乙酸和某醇生成的酯的分子式为C21H32O4,1molC21H32O4完全水解可得到2mol CH3COOH和1mol醇,该醇的分子式( )
| A. | C16H30O2 | B. | C17H26O4 | C. | C18H28O2 | D. | C17H28O2 |
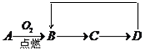 A-D是含同一元素的四种物质,相互之间有如图的转化关系,其中A是单质,D是最高价氧化物的水合物.那么A不可能是( )
A-D是含同一元素的四种物质,相互之间有如图的转化关系,其中A是单质,D是最高价氧化物的水合物.那么A不可能是( )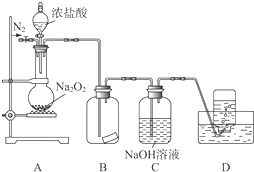 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.