题目内容
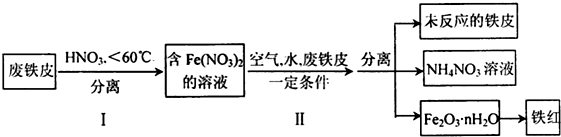
10.亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛.现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示:
已知:室温下,①2NO+Na2O2═2NaNO2②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO或NO2都能与MnO4-反应生成NO3-和Mn2+.完成下列填空:
(1)检查装置气密性的方法是将试管中加入水,关闭弹簧夹,用酒精灯轻轻加热三颈烧瓶,若导管口有气泡冒出且停止加热后,在导管中形成一段水柱,说明装置气密性良好;
(2)写出浓硝酸与木炭反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)B中观察到的主要现象是有无色气体产生和铜片逐渐溶解,溶液变为蓝色,D装置的作用是除去未反应的NO,防止污染空气;
(4)硬质玻璃管中石棉绒的作用是增大NO和Na2O2的接触面积,使反应更加充分;
(5)检验C中产物有亚硝酸钠的方法是取样,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠;
(6)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称碱石灰.
分析 (1)必须时密闭系统才可以检查装置气密性,因此需要先关闭活塞及试管里加水,使导管插入水中,然后利用气体的热胀冷缩原理检验;
(2)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,依据氧化还原反应电子守恒和原子守恒配平;
(3)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
(4)将Na2O2洒在石棉绒上,增大了与NO气体的接触机会,也有利于气体流通;
(5)依据亚硝酸钠具有氧化性或还原性,选择还原剂或氧化剂发生的反应现象证明产物中是否是亚硝酸钠;
(6)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠;为避免产生这些副产物,应在B、C装置间增加装置,除去二氧化碳和水蒸气;
解答 解:(1)根据气体热胀冷缩原理检查气密性,具体操作是将试管中加入水,关闭弹簧夹,用酒精灯轻轻加热三颈烧瓶,若导管口有气泡冒出且停止加热后,在导管中形成一段水柱,说明装置气密性良好,故答案为:将试管中加入水,关闭弹簧夹,用酒精灯轻轻加热三颈烧瓶,若导管口有气泡冒出且停止加热后,在导管中形成一段水柱,说明装置气密性良好;
(2)装置A中是浓硝酸和碳加热发反应,反应生成二氧化氮和二氧化碳和水,反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,硝酸和铜反应生成硝酸铜,一氧化氮和水,所以反应现象为溶液变蓝,铜片溶解,导管口有无色气体冒出;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
故答案为:铜片溶解,溶液变蓝,导管口有无色气体冒出;除去未反应的NO,防止污染空气;
(4)使用石棉绒可以增大NO和Na2O2的接触面积,使反应更加充分,故答案为:增大NO和Na2O2的接触面积,使反应更加充分;
(5)检验亚硝酸钠的实验设计为:取少量生成物置于试管中,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠.
故答案为:取样,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠;
(6)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加盛装碱石灰的装置,可除去二氧化碳和水蒸气,故答案为:碱石灰.
点评 本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,注意实验过程中的反应现象分析,掌握基础是关键,题目难度中等.

| A. | 酸碱中和反应 | B. | 氯酸钾分解为氧气和氯化钾的反应 | ||
| C. | 物质燃烧反应 | D. | 实验室制H2的反应 |
| A. | 盐酸、苛性钠、偏铝酸钠 | B. | 硅酸、乙醇、小苏打 | ||
| C. | 硫酸、纯碱、硅酸钠 | D. | 碳酸、烧碱、一水合氨 |
| A. | 燃烧 | B. | 浓硫酸溶于水 | C. | 酸碱中和 | D. | 水的电离 |
| A. | 有$\frac{1}{2}$NA个硫原子被还原 | B. | 有$\frac{1}{3}$NA个氮原子被氧化 | ||
| C. | 有$\frac{3}{4}$NA个二氧化硫分子生成 | D. | 有$\frac{2}{3}$NA个硫酸铵分解 |
所用酸性KMnO4溶液的浓度可选择0.010mol•L-1、0.0010mol•L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.10mol•L-1)的用量均为2mL.
(1)已知草酸溶液中各种微粒存在形式的分布曲线图如图1,请写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.

(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③ 探究温度对反应速率的影响; c.实验①和④ 探究催化剂对反应速率的影响. |
| ② | ||||
| ③ | 0.010 | |||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| Ⅰ | 14.0 | 13.0 | 11.0 |
| Ⅱ | 6.5 | 6.7 | 6.8 |
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应
(4)该反应的催化剂选择MnCl2还是MnSO4并简述选择的理由:MnSO4,如选用MnCl2,则酸性高锰酸钾会与Cl-反应,而且引入了Cl-无法证明是Mn2+起了催化作用
(5)化学催化剂有很多,在生产和科技领域起到重大作用.探究小组又利用乙装置探究MnO2对H2O2分解的催化效果.将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如图2所示.
①实验时放出气体的总体积是110mL.
②b小于(填“大于”“小于”或“等于”)90mL.