题目内容
10.下列物质中,既能与盐酸反应,又能与KOH溶液反应的是( )①NaHCO3
②AgNO3③(NH4)2S
④HOOC-COONa
⑤

⑥

| A. | 全部 | B. | ①②④⑤⑥ | C. | ②③④⑤⑥ | D. | ②④⑤⑥ |
分析 Al、氧化铝、氢氧化铝、弱酸酸式盐、弱酸的铵盐、氨基酸、蛋白质等物质能和稀盐酸、KOH溶液反应,据此分析解答.
解答 解:①NaHCO3 为弱酸酸式盐,能和稀盐酸、KOH反应生成盐,故正确;
②AgNO3为强酸弱碱盐,能和稀盐酸、KOH都发生复分解反应,故正确;
③(NH4)2S为弱酸的铵盐,能和稀盐酸、KOH都反应,故正确;
④HOOC-COONa为弱酸酸式盐,和稀盐酸、KOH都反应,故正确
⑤ 中含有氨基和羧基,所以和稀盐酸、KOH都反应,故正确;
中含有氨基和羧基,所以和稀盐酸、KOH都反应,故正确;
⑥ 含有酚羟基,能和KOH反应,含有-COONa,能和稀盐酸反应,故正确;
含有酚羟基,能和KOH反应,含有-COONa,能和稀盐酸反应,故正确;
故选A.
点评 本题考查元素化合物性质,为高频考点,明确能和稀盐酸、KOH溶液反应的物质性质是解本题关键,注意④为有机酸的酸式盐、酚具有酸性,注意基础知识的积累,题目难度不大.

练习册系列答案
相关题目
1.下列关于原电池的叙述正确的是( )
| A. | 构成原电池的正极和负极必须是两种不同的金属 | |
| B. | 任何化学反应只要是自发进行的放热反应都可以被设计成原电池 | |
| C. | 在原电池中,电子流出的一极是负极,该电极被还原 | |
| D. | 原电池是化学能转变为电能的装置,为外界提供电能 |
18.对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A. | 某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1(NH4)2SO4溶液中:c(H+)>c(NH4+) | |
| C. | 0.1mol•L-1的HCl溶液与0.1mol•L-1的NaOH溶液等体积混合:c(H+)+c(Na+)═c(OH-)+c(Cl-) | |
| D. | 0.1mol•L-1 CH3COONa溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
5.下列物质的分类中,前者是电解质,后者是非电解质的组合是( )
| A. | 空气、Cl2 | B. | NaHCO3、蔗糖 | C. | Ba(OH)2、CH3CH2OH | D. | H2SO4、盐酸 |
15.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
2.短周期主族元素 X、Y、Z、W、Q 的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z 的单质能溶于 W 的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法不正确的是( )
| A. | 原子半径的大小顺序为 W>Q>Z>X>Y | |
| B. | 元素 Y 与 W 对应氢化物的沸点 H2Y>H2W | |
| C. | 元素 X 与 Y 可以形成 5 种以上的化合物 | |
| D. | 元素 Q 的最高价氧化物对应的水化物酸性比 W 的强 |
3.如图,此有机物的系统命名正确的是( )
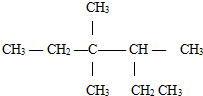

| A. | 3,3-二甲基-2-乙基戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 3,3,4-三甲基己烷 | D. | 3,4,4-三甲基己烷 |
