题目内容
现有电解质溶液①Na2CO3,②NaHCO3,③NaAlO2,④CH3COONa,⑤NaOH
(1)当五种溶液的浓度相同时,溶液中由水电离出的H+的物质的量浓度由大到小的顺序是 (填序号).
(2)在上述五种电解质溶液中,分别加入AlCl3溶液,有气体产生的是 (填序号).
(3)将上述①②③④四种电解质溶液混合,发生反应的离子方程式为 .
(1)当五种溶液的浓度相同时,溶液中由水电离出的H+的物质的量浓度由大到小的顺序是
(2)在上述五种电解质溶液中,分别加入AlCl3溶液,有气体产生的是
(3)将上述①②③④四种电解质溶液混合,发生反应的离子方程式为
考点:盐类水解的应用
专题:盐类的水解专题
分析:(1)溶液中溶质浓度相同,酸越弱,其盐的酸根水解程度越大,据此解答.
(2)碳酸根、碳酸氢根与铝离子发生彻底双水解反应生成氢氧化铝与二氧化碳;
(3)碳酸氢钠能电离出氢离子,氢离子和偏铝酸钠反应,符合强酸制取弱酸.
(2)碳酸根、碳酸氢根与铝离子发生彻底双水解反应生成氢氧化铝与二氧化碳;
(3)碳酸氢钠能电离出氢离子,氢离子和偏铝酸钠反应,符合强酸制取弱酸.
解答:
解:(1)①、②、③、④是强碱弱酸盐,水解显碱性促进水的电离,⑤是碱抑制水的电离,①、②、③、④四种盐的阳离子相同,其阴离子对应的酸越弱,酸根的水解程度越大,酸性:醋酸>碳酸>碳酸氢根>偏铝酸,③①②④,碱溶液中水电离氢离子浓度最小;
故答案为:③①②④⑤;
(2)碳酸根、碳酸氢根与铝离子发生彻底双水解反应生成氢氧化铝与二氧化碳,NaAlO2与氯化铝发生双水解反应生成氢氧化铝沉淀,CH3COONa与氯化铝不反应,NaOH与氯化铝反应生成氢氧化铝沉淀,
故答案为:①②;
(3)碳酸氢钠能电离出氢离子,氢离子和偏铝酸钠反应生成碳酸钠和氢氧化铝,反应离子方程式为:
H2O+HCO3-+AlO2-═CO32-+Al (OH)3↓,
故答案为:H2O+HCO3-+AlO2-═CO32-+Al (OH)3↓;
故答案为:③①②④⑤;
(2)碳酸根、碳酸氢根与铝离子发生彻底双水解反应生成氢氧化铝与二氧化碳,NaAlO2与氯化铝发生双水解反应生成氢氧化铝沉淀,CH3COONa与氯化铝不反应,NaOH与氯化铝反应生成氢氧化铝沉淀,
故答案为:①②;
(3)碳酸氢钠能电离出氢离子,氢离子和偏铝酸钠反应生成碳酸钠和氢氧化铝,反应离子方程式为:
H2O+HCO3-+AlO2-═CO32-+Al (OH)3↓,
故答案为:H2O+HCO3-+AlO2-═CO32-+Al (OH)3↓;
点评:本题主要考查盐类水解等,难度中等,注意对盐类水解规律的理解,注意掌握常见彻底双水解反应.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
 美丽的“水立方”(Water Cube)是北京奥运会游泳馆,设计灵感来自于有机细胞的天然图案以及肥皂泡的形成.在这个中心的蓝色汽泡墙之内,钢结构的基本单位是一个由 12 个正五边形和2个正六边形所组成的几何细胞.覆盖这个框架的是半透明的汽泡,称为PTFE膜(聚四氟乙烯),它能为场馆内带来更多的自然光.根据以上信息,下列说法不正确的是( )
美丽的“水立方”(Water Cube)是北京奥运会游泳馆,设计灵感来自于有机细胞的天然图案以及肥皂泡的形成.在这个中心的蓝色汽泡墙之内,钢结构的基本单位是一个由 12 个正五边形和2个正六边形所组成的几何细胞.覆盖这个框架的是半透明的汽泡,称为PTFE膜(聚四氟乙烯),它能为场馆内带来更多的自然光.根据以上信息,下列说法不正确的是( )| A、若设想将一个结构单元钢棍焊成足球形状“碳笼”,它与C24形状相似 |
| B、若设想将一个结构单元钢棍焊成足球形状“碳笼”,需钢棍(相当于键)36 根 |
| C、PTFE的单体为:CF2=CF2 |
| D、PTFE在空气中易被氧气氧化 |
下列物质属于电解质的是( )
①NaOH ②C2H5OH ③NH3 ④BaSO4 ⑤HCl ⑥Cu.
①NaOH ②C2H5OH ③NH3 ④BaSO4 ⑤HCl ⑥Cu.
| A、①④⑤ | B、①③⑤ |
| C、①④⑤⑥ | D、③④⑤ |
 ⑨
⑨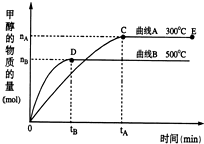 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)