题目内容
有某可燃有机物A测得其相对分子质量为46,取4.6克样品在足量的空气中完全燃烧可以生成8.8克二氧化碳和5.4克水,求该有机物的化学式及画出可能的分子结构式.
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:根据有机物燃烧生成二氧化碳、水的质量计算出碳元素、氢元素的物质的量、质量,然后判断是否含有氧原子,并计算出氧原子的质量、物质的量,再根据有机物的摩尔质量计算出4.6g该有机物的物质的量,最后确定其分子式、结构式.
解答:
解:一种物质燃烧只生成水和二氧化碳,则该物质肯定含有C、H元素,是否含氧则需要根据质量守恒定律判断,
8.8g二氧化碳的物质的量为:n(CO2)=
=0.2mol,含有碳原子质量为m(C)=12g/mol×0.2mol=2.4g,
5.4g水的物质的量为:n(H2O)=
=0.3mol,0.3mol水中含有0.6molH原子,含氢元素的质量为1g/mol×0.6mol=0.6g,
4.6g有机物分子中含有C、H元素的质量为:2.4g+0.6g=3.0g<4.6g,该有机物中一定含有O原子,含有氧原子的质量为4.6g-3.0g=1.6g,
含有氧原子的物质的量为:n(O)=
=0.1mol,
4.6g该有机物的物质的量为:
=0.1mol,
该有机物分子中含有C、H、O原子的数目为:
=2、
=6、
,
所以该有机物的分子式为:C2H6O;
分子式为C2H6O的有机物可能为乙醇,结构式为: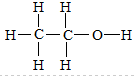 ;有可能为甲醚,结构式为:
;有可能为甲醚,结构式为: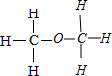 ,
,
答:该有机物的分子式为C2H6O;可能的分子结构式为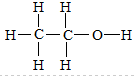 或
或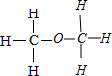 .
.
8.8g二氧化碳的物质的量为:n(CO2)=
| 8.8g |
| 44g/mol |
5.4g水的物质的量为:n(H2O)=
| 5.4g |
| 18g/mol |
4.6g有机物分子中含有C、H元素的质量为:2.4g+0.6g=3.0g<4.6g,该有机物中一定含有O原子,含有氧原子的质量为4.6g-3.0g=1.6g,
含有氧原子的物质的量为:n(O)=
| 1.6g |
| 16g/mol |
4.6g该有机物的物质的量为:
| 4.6g |
| 46g/mol |
该有机物分子中含有C、H、O原子的数目为:
| 0.2mol |
| 0.1mol |
| 0.6mol |
| 0.1mol |
| 0.1mol |
| 0.1mol |
所以该有机物的分子式为:C2H6O;
分子式为C2H6O的有机物可能为乙醇,结构式为:
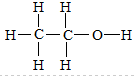 ;有可能为甲醚,结构式为:
;有可能为甲醚,结构式为: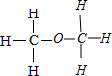 ,
,答:该有机物的分子式为C2H6O;可能的分子结构式为
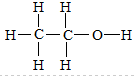 或
或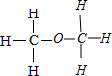 .
.
点评:本题考查了有机物分子式的计算、结构式的书写,题目难度中等,试题较好的考查了学生的分析、计算能力及对元素守恒以及质量守恒的运用,属于典型的习题,根据质量守恒确定氧元素的存在情况为易错点.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
对于达到平衡的可逆反应H2(g)+I2(g)?2HI(g) (正反应是放热反应),欲使混合气体的颜色变深,应采取的措施是( )
| A、升高温度 | B、降低温度 |
| C、增大压强 | D、减少压强 |
在强碱性溶液中,下列离子组能大量共存的是( )
| A、Al3+、Na+、SO42-、Cl- |
| B、Na+、Cu2+、SO42-、NO3- |
| C、Na+、Ba2+、NO3-、Cl- |
| D、Ba2+、HCO3-、NO3-、K+ |
 如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.
如图所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.