题目内容
16.某元紊素X的部分电离能数据列在下表中,| 电离能序号 | I1 | I2 | I3 | I4 |
| 电离能(kJ/mol) | 740 | 1500 | 7700 | 10500 |
| A. | s区 | B. | p区 | C. | d区 | D. | ds区 |
分析 根据第一至第四电离能的变化可判断易失去的电子数,再判断再判断元素X的最外层电子数,周期表分为s区、p区、d区、ds区、f区,根据最外层电子数结合最后填充的电子,判断元素X在元素周期表中,最可能位于的区域.
解答 解:已知某元素的电离能(I1/kJ•mol-1):I1=740,I2=1500,I3=7700,I4=10500,从该元素的第一至第四电离能可以看出,元素的第一、第二电离能都较小,第三、第四电离能较大,说明该元素的原子容易失去2个电子,则该元素原子的最外层有2个电子,元素周期表的元素划分为5区,除了ds区外,区的名称来自构造原理最后填入电子能级的符号.s区元素是由第IA族和第IIA族元素组成,p区的外围电子排布为ns2npx(包含氦氦元素,氦除外),包含ⅢA~ⅦA族元素与零族元素,d区元素包括周期系第ⅢB~ⅦB,ⅤⅢ,ⅠB~ⅡB元素,ds区元素是指元素周期表中的ⅠB、ⅡB两族元素,元素原子的最外层有2个电子,所以最可能位于S区,
故选A.
点评 本题考查元素电离能含义及应用,注意把握根据电离能数值的变化来判断元素最外层电子数的方法,题目难度不大,注意知识的积累,注意掌握元素周期表中各区的划分.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
6.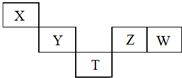 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )| A. | YW4与H2在高温下反应主要生成YH4和HW | |
| B. | X的原子半径比T原子半径小,两者原子序数之差为29 | |
| C. | W氧化物的水化物的酸性一定强于Z的氧化物的水化物 | |
| D. | T的氢化物可能具有强的还原性,其稳定性小于Z的氢化物 |
11.下列说法不正确的是( )
| A. | 甲烷与乙烯共1mol,完全燃烧后生成的H2O为2mol | |
| B. | 苯和苯乙烯都不能使酸性高锰酸钾溶液褪色 | |
| C. | 甲烷、苯都属于烃,都不存在同分异构体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
1.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,22.4L臭氧与22.4L氢气所含原子数均为2NA | |
| B. | 46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 2.24LCH4所含电子数为NA | |
| D. | 1molO2参加反应转移的电子数一定为4NA |
8.下列分子中的各原子均在同一平面上的是( )
| A. | C2H3Cl | B. | CHCl3 | C. | CH3CH═CH2 | D. | CH3-CH3 |
6.称取(NH4)2SO4和NH4HSO4混合物样品7.24g,加入含0.1molNaOH的溶液,完全反应,生成NH3 1792ml(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )
| A. | 1:1 | B. | 1:2 | C. | 1.87:1 | D. | 3.65:1 |