题目内容
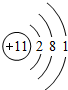
16.A、B、C和D是同一周期的四种元素,A、B、C的原子序数依次相差1;A元素的单质化学性质最活泼,能与水直接发生反应.B元素的氧化物2.0g恰好跟100mL0.5mol/L的H2SO4完全反应.B元素的单质跟D元素单质反应生成BD2型化合物.根据以上事实回答:(1)A原子的结构示意图为
(2)C在周期表中的位置:第三周期ⅢA族
(3)BD2含有的化学键类型为离子键
(4)A、C两元素最高价氧化物的水化物相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
分析 A、B、C、D是同一周期的四种元素,A元素的单质化学性质活泼、能与水直接发生反应,则A处于ⅠA族;
A、B、C的原子序数依次相差为1,则B处于ⅡA族、C处于ⅢA族;
B的氧化物为BO,氧化物BO的物质的量等于硫酸的物质的量=0.1L×0.5mol/L=0.05mol,BO的相对分子质量为:$\frac{2.0g}{0.05mol}$=40g/mol,则B的相对原子质量为:40-16=24,则B为Mg元素、故A为Na、C为Al;
B元素的单质跟D元素单质反应生成化合物BD2,B为+2价,则D为-1价,所以D为Cl元素,结合题目分析解答.
解答 解:、B、C、D是同一周期的四种元素,A元素的单质化学性质活泼、能与水直接发生反应,则A处于ⅠA族;
A、B、C的原子序数依次相差为1,则B处于ⅡA族、C处于ⅢA族;
B的氧化物为BO,氧化物BO的物质的量等于硫酸的物质的量=0.1L×0.5mol/L=0.05mol,BO的相对分子质量为:$\frac{2.0g}{0.05mol}$=40g/mol,则B的相对原子质量为:40-16=24,则B为Mg元素、故A为Na、C为Al;
B元素的单质跟D元素单质反应生成化合物BD2,B为+2价,则D为-1价,所以D为Cl元素,
(1)A为Na,其原子序数为11,最外层含有1个电子,Na的原子结构为: ,故答案为:
,故答案为: ;
;
(2)C是Al元素,其原子核外有3个电子层、最外层电子数是3,所以C位于第三周期第IIIA族,
故答案为:第三周期ⅢA族;
(3)MgCl2中镁离子和氯离子只存在离子键,故答案为:离子键;
(4)A、C两元素最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查位置结构性质相互关系,为高频考点,明确原子结构、元素周期表结构、物质构成是解本题关键,注意氢氧化铝的两性,题目难度不大.

| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | Zn 具有还原性和导电性,可用作锌锰干电池的负极材料 | |
| D. | 由2 mol H原子形成1 mol H-H键要吸收热量 |
①甲单质能与乙的盐溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙的原子半径
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙的原子序数
④两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙失去的电子数多.
| A. | 全部可以 | B. | 仅②不可以 | C. | 仅②④不可以 | D. | 仅③可以 |
| A. | 将得到的m g固体放到氧气中充分灼烧后,固体质量变为4.8 g | |
| B. | 生成的CO2已被Ba(OH)2溶液完全吸收,Ba2+沉淀完全 | |
| C. | Ba(OH)2溶液吸收CO2后的溶液中有BaCO3和Ba(HCO3)2,且物质的量的比为2:1 | |
| D. | 原混合物中CuO与Fe2O3的质量比为2:1 |
 香兰素是重要的香料之一,它可由丁香酚经多步反应合成(如图),有关如图两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香酚经多步反应合成(如图),有关如图两种化合物的说法正确的是( )| A. | 常温下,1mol丁香酚只能与1mol Br2发生反应 | |
| B. | 香兰素分子中至少有12个原子共平面 | |
| C. | 1mol香兰素最多能与3mol氢气发生加成反应 | |
| D. | 丁香酚不能与FeCl3溶液发生显色反应 |
| A. | V(H2)=0.1 mol•L-1•S-1? | B. | V(N2)=0.2 mol•L-1•S-1? | ||
| C. | V(NH3)=0.15 mol•L-1•S-1? | D. | V(H2)=18 mol•L-1•min-1? |
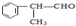 的物质,该物质是一种香料.
的物质,该物质是一种香料.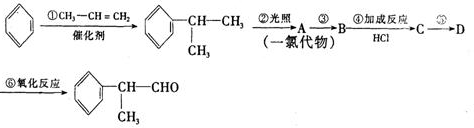
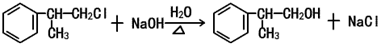
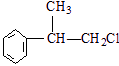 、
、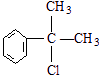 .
.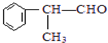 的官能团的名称醛基.
的官能团的名称醛基.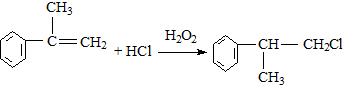 .
. .
.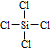 .
.