题目内容
13.设NA为阿伏加德罗常数的值,下列说法不正确的是( )| A. | 46g C2H6O中含有的C-H键数一定为5NA | |
| B. | 常温常压下,17g 甲基(-14CH3)所含电子总数为9NA | |
| C. | 制粗硅时12g C能还原含2NASi-O键的SiO2 | |
| D. | CO2气体与足量的Na2O2反应,固体增重28g时转移了NA个电子 |
分析 A、C2H6O可能为乙醇,还可能为二甲醚;
B、求出甲基(-14CH3)的物质的量,然后根据1mol甲基(-14CH3)中含9mol电子来分析;
C、求出碳的物质的量,然后根据在制取粗硅的反应中,1molC~$\frac{1}{2}$molSiO2来计算,而1mol二氧化硅中含4mol硅氧键;
D、过氧化钠和二氧化碳反应时,增重的为CO的质量,且反应掉1molCO2~增重28g~转移1mol电子,据此分析.
解答 解:A、C2H6O可能为乙醇,还可能为二甲醚,当为二甲醚时,46g即1mol中含6NA条C-H键,故A错误;
B、17g甲基(-14CH3)的物质的量为1mol,而1mol甲基(-14CH3)中含9mol电子,故含9NA个,故B正确;
C、12g碳的物质的量为1mol,而在制取粗硅的反应中,1molC~$\frac{1}{2}$molSiO2,而1mol二氧化硅中含4mol硅氧键,故0.5mol二氧化硅中含2NA条硅氧键,故C正确;
D、过氧化钠和二氧化碳反应时,增重的为CO的质量,且反应掉1molCO2~增重28g~转移1mol电子,故当固体增重28g时转移NA个电子,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
3.关于硫和氧的性质叙述正确的是( )
| A. | 硫在O2中燃烧生成SO2 | B. | 硫在O2中燃烧生成SO3 | ||
| C. | 硫的非金属性比氧的强 | D. | 氧、硫均只有氧化性 |
1.下列关于弱电解质的电离平衡常数的叙述中,正确的是( )
| A. | 因为电离过程是吸热过程,所以温度越高,同一弱电解质的电离平衡常数越大,电离度越小 | |
| B. | 弱电解质的电离平衡常数是由各微粒的平衡浓度表达的,所以弱电解质的电离平衡常数只与浓度有关 | |
| C. | 对于不同的弱酸,电离平衡常数越大,酸性一定越强,可以通过电离平衡常数的大小判断弱酸的相对强弱 | |
| D. | 弱电解质的电离平衡常数是衡量弱电解质电离程度大小的一种方法 |
5.新型材料纳米级铁粉与普通铁粉具有不同的性质.已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同:温度低于570℃时生成FeO,高于570℃时生成Fe3O4.甲同学用图1所示装置进行纳米级铁粉与水蒸气反应的实验:
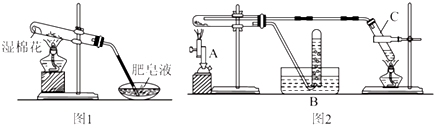
(1)该装置中纳米级铁粉与水蒸气反应的化学方程式是Fe+H2O(g)$\frac{\underline{\;高温\;}}{\;}$FeO+H2.
乙同学用图2所示装置进行纳米级铁粉与水蒸气的反应并验证产物:
(2)装置C的作用是制取水蒸气.
(3)酒精灯和酒精喷灯都是实验室常用的加热仪器,在该实验中应先点燃酒精灯.
(4)不能撤除收集气体产物装置B的原因是氢气遇明火可能发生爆炸.
(5)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
乙同学认为该条件下反应的固体产物为FeO.丙同学认为该结论不正确,他的理由是Fe+2H+═2Fe2++H2↑,2Fe3++Fe═3Fe2+(用离子方程式表示).
(6)丁同学称取5.60 g铁粉,用图2所示装置反应一段时候后,停止加热.将试管内的固体物质在干燥器中冷却后,称得质量为6.88 g.然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗FeCl3 0.08 mol.则丁同学所做实验的固体产物为Fe3O4.

(1)该装置中纳米级铁粉与水蒸气反应的化学方程式是Fe+H2O(g)$\frac{\underline{\;高温\;}}{\;}$FeO+H2.
乙同学用图2所示装置进行纳米级铁粉与水蒸气的反应并验证产物:
(2)装置C的作用是制取水蒸气.
(3)酒精灯和酒精喷灯都是实验室常用的加热仪器,在该实验中应先点燃酒精灯.
(4)不能撤除收集气体产物装置B的原因是氢气遇明火可能发生爆炸.
(5)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后的黑色粉末X(假定成分分布均匀)取出少量,放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验Ⅰ中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
(6)丁同学称取5.60 g铁粉,用图2所示装置反应一段时候后,停止加热.将试管内的固体物质在干燥器中冷却后,称得质量为6.88 g.然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗FeCl3 0.08 mol.则丁同学所做实验的固体产物为Fe3O4.
12.已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
10.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
| A. | CH3CH2CH2CH3 | B. | CH3CH3 | C. | CH3C(CH3)3 | D. | (CH3)2CHCH2CH3 |
