题目内容
7.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 标准状况下,11.2LCCl4中含有的分子数为0.5NA | |
| B. | 1molCl2完全溶于水,转移的电子数为NA | |
| C. | 25℃时,PH=13的1.0LBa(OH)2溶液中含有的OH-数为0.1NA | |
| D. | 电解精炼铜,转移2NA个电子时,阳极溶解64g铜 |
分析 A.气体摩尔体积适用对象为气体;
B.氯气与水反应为可逆反应;
C.依据PH计算氢离子浓度,结合溶液中离子积常数计算碱溶液中氢氧根离子浓度;
D.粗铜中含有杂质铁、锌等,活泼性强于铜,优先放电.
解答 解:A.标况下,四氯化碳是液态,不能使用气体摩尔体积,故A错误;
B.氯气与水反应为可逆反应,不能进行到底,1molCl2完全溶于水,转移的电子数小于NA,故B错误;
C.pH=13的Ba(OH)2溶液中C(H+)=10-13mol/L,C(H+)=0.1mol/L,根据n=CV可知OH-的物质的量n=1L×0.1mol/L=0.1mol,故个数为0.1NA,故C正确;
D.电解精炼铜过程中,由于阳极粗铜中还原杂质铁、锌,电解是铁和锌原先铜放电,所以当外电路通过2NA个电子时,阳极溶解铜的物质的量小于1mol,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的判断及计算,熟练掌握以物质的量为中心的各物理量之间的转化关系是解题关键,注意气体摩尔体积的使用对象和条件,注意可逆反应的特点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.某工业上可采用以下步骤生产乙醇:

下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 该过程中硫酸是催化剂 | B. | 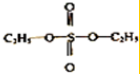 可属于二元酯 可属于二元酯 | ||
| C. | 该过程中①、②是加成反应 | D. | 该过程中③、④是水解反应 |
15.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
| A. | 正丁烷 | B. | 异丁烷 | C. | 丙烷 | D. | 甲烷 |
2.下列关于甲烷的说法正确的是( )
| A. | 甲烷是含碳元素质量分数最高的有机物 | |
| B. | 1mol甲烷与1molCl2反应恰好生成1mol一氯甲烷 | |
| C. | CH2ClCH2Cl有 和 和 两种同分异构体 两种同分异构体 | |
| D. | 有机物中的碳原子之间能以共价键结合,形成多种链状和环状 |
12. 利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图,a、b为惰性电极,利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的,下列说法不正确的是( )
利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图,a、b为惰性电极,利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的,下列说法不正确的是( )
 利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图,a、b为惰性电极,利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的,下列说法不正确的是( )
利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图,a、b为惰性电极,利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的,下列说法不正确的是( )| A. | a电极反应式为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| B. | 反应过程中产生的质子透过阳离子交换膜扩散到好氧区 | |
| C. | 电流从右侧电极经过负载后流向左侧电极 | |
| D. | 常温下,用该电池电解一定量的饱和硫酸铜溶液(电极为惰性电极),其中水的电离平衡向左移动 |
19.下列物质属于电解质的是( )
①Cu ②食盐 ③蔗糖 ④CO2 ⑤BaSO4 ⑥KNO3.
①Cu ②食盐 ③蔗糖 ④CO2 ⑤BaSO4 ⑥KNO3.
| A. | ④⑤ | B. | ④⑤ | C. | ②⑥ | D. | ⑤⑥ |
16.下列有关离子键,共价键的叙述中正确的是( )
| A. | 离子化合物中只存在离子键,没有共价键 | |
| B. | 共价化合物分子中一定不存在离子键 | |
| C. | 构成单质的粒子中一定含有共价键 | |
| D. | 仅由非金属元素组成的化合物中一定不含离子键 |
17.现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下:
据此,将甲和乙互相分离的最佳方法是( )
| 物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) | 水中溶解性 |
| 甲 | C3H6O2 | -98 | 47.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 87 | 0.90 | 可溶 |
| A. | 萃取法 | B. | 升华法 | C. | 蒸馏法 | D. | 分液法 |
 以下各单质和化合物之间存在如图所示转化关系:
以下各单质和化合物之间存在如图所示转化关系: