题目内容
19.在热的稀硫酸中溶解了7.6gFeSO4固体,当加入50mL 0.5mol•L-1 KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体.(1)推算出x=2;y=3.(其中x、y均为正整数,且没有公约数)
(2)配平该反应的方程式并用单线桥法标出电子转移的情况
FeSO4+2KNO3+3H2SO4=1K2SO4+2Fe2(SO4)3+N2O3↑+3H2O
(配平系数若为“1”,也必须写出,配平时x、y用(1)中求解的具体数值表示,物质填在□中).
(3)反应中氧化产物是Fe2(SO4)3.
(4)标准状况下,当生成NxOy气体的体积为2.24L时,转移的电子数目为0.4NA.
分析 (1)Fe2+失电子Fe3+,则硫酸亚铁作还原剂,所以硝酸中氮元素得电子化合价降低作氧化剂,利用电子守恒计算;
(2)反应中Fe的化合价从+2价到+3价,N元素的化合价从+5价降低到+3;根据化合价升降总数相等和质量守恒来配平方程式;双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子或原子团,要标明电子的得失字样及得失电子数目;
(3)氧化还原反应中还原剂失电子发生氧化反应生成的产物为氧化产物;
(4)根据NxOy与电子之间的关系计算.
解答 解:n(FeSO4)=$\frac{7.6g}{152g/mol}$=0.05mol,n(KNO3)=0.05L×0.5mol/L=0.025mol,
Fe2+失电子Fe3+,则硫酸亚铁作还原剂,所以硝酸中氮元素得电子化合价降低作氧化剂,
由电子守恒可知,Fe失去电子等于N得到电子,设N被还原后元素化合价为m,则
0.05mol×(3-2)=0.025mol×(5-m),
解得m=+3,只有N2O3中N元素的化合价为+3价,则x=2,y=3;
故答案为:2;3;
(2)FeSO4中铁的化合价由+2价升高为+3价,变化1,KNO3中氮的化合价由+5价降低为+3价,变化2,化合价升降总数相等和质量守恒来配平方程式为:
4FeSO4+2KNO3+3H2SO4=K2SO4+2Fe2(SO4)3+N2O3↑+3H2O,用单线桥法标出电子转移为 ;
;
故答案为:4;2;3;1;2;1;3; ;
;
(3)氧化还原反应中还原剂失电子发生氧化反应生成的产物为氧化产物,所以反应中氧化产物是Fe2(SO4)3;
故答案为:Fe2(SO4)3;
(4)标准状况下,当生成N2O3气体的体积为2.24L时,即0.1mol转移电子为0.1mol×2×(5-3)=0.4mol,即0.4NA个,
故答案为:0.4NA.
点评 本题主要考查了氧化还原反应的计算、氧化还原反应的配平、氧化产物的判断及分析氧化还原反应用,题目难度中等,注意基础知识的掌握,明确元素的化合价变化来分析是解答本题的关键.

 “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )| A. | Mg电极的电极反应式:Mg-2e-=Mg2+ | |
| B. | 这种电池的工作原理可以认为是镁的吸氧腐蚀 | |
| C. | 活性炭电极上发生氧化反应 | |
| D. | 电池工作时实现了化学能向电能的转化 |
 某有机物的结构为如图所示,这种有机物不可能具有的性质是( )
某有机物的结构为如图所示,这种有机物不可能具有的性质是( )①可以燃烧;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生水解反应.
| A. | ①④ | B. | 只有⑤ | C. | ②⑤ | D. | ④⑤ |
 表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).| 电解质 | 电离方程式 | 电离常数K | Ksp |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K3=2.20×10-13 | - |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | - |
| NH3•H2O | NH3•H2O?OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s)?Ba2++SO42- | - | 1.1×10-10 |
| BaCO3 | BaCO3(s)?Ba2++CO32- | - | 1×10-9 |
(1)写出C6H5OH与Na3PO4反应的离子方程式:C6H5OH+PO43-=C6H5O-+HPO42-.
(2)25℃时,向10mL 0.01mol/LC6H5OH溶液中滴加V mL 0.1mol/L氨水,混合溶液中粒子浓度关系正确的是b(填序号).
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3•H2O)+2c(NH4+)═c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01mol/L C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义.25℃时,Na2CO3第一步水解反应的水解常数Kb=1.78×10-4mol/L.
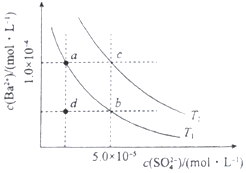
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大).
①T2> 25℃(填“>”、“<”或“=”)
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是bc(填序号).
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
③某课外活动小组为探究BaSO4的溶解度,分子将足量的BaSO4放入:
a.5mL水
b.20mL 0.5mol•L-1的Na2SO4溶液
c.40mL 0.2mol•L-1的Ba(OH)2溶液
d.40mL 0.1mol•L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是A,BaSO4的溶解度的大小顺序为C(填序号).
A.c>a>d>b B.c>a>b>d C.a>d>c>b D.a>c>d>b
④在BaCO3和BaSO4混合物悬浊液中,c(SO42-)与c(CO32-)之比为0.11(或1.1×10-1).
①N2H4(l)+$\frac{1}{2}$N2O4(l)═$\frac{3}{2}$N2(g)+2H2O(l)△H=-546.45kJ/mol
②H2O(g)═H2O(l)△H=-44.0kJ/mol
则2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) 的△H是( )
| A. | -916.9 kJ/mol | B. | -458.45 kJ/mol | C. | +916.9 kJ/mol | D. | +458.45 kJ/mol |
| A. | 在一定条件下,苯分别与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| B. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| C. | 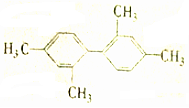 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 聚合物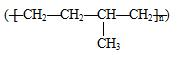 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |