题目内容
室温下,下列说法错误的是( )
| A、0.1 mol?L-1的CH3COOH溶液中,由水电离的c(H+)为10-13mol?L-1 |
| B、pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 |
| C、pH=12的NaOH溶液和pH=2的CH3COOH溶液等体积混合后溶液的pH<7 |
| D、将1 L 0.1 mol?L-1的Ba(OH)2溶液稀释为2 L,pH=13 |
考点:pH的简单计算,弱电解质在水溶液中的电离平衡
专题:
分析:A.醋酸溶液中的氢氧根离子是水电离的,但是醋酸为弱酸,溶液中只能部分电离出氢离子,所以氢离子浓度小于0.1mol/L;
B.根据c(H+)=10-pH进行计算pH=2与pH=1的CH3COOH溶液中c(H+)之比;
C.醋酸为弱酸,溶液中存在电离平衡,则醋酸的浓度大于0.01mol/L,两溶液混合后醋酸过量,溶液显示酸性;
D.先计算出稀释后的溶液中氢氧根离子浓度,然后根据pH=-lgc(H+)计算出溶液的pH.
B.根据c(H+)=10-pH进行计算pH=2与pH=1的CH3COOH溶液中c(H+)之比;
C.醋酸为弱酸,溶液中存在电离平衡,则醋酸的浓度大于0.01mol/L,两溶液混合后醋酸过量,溶液显示酸性;
D.先计算出稀释后的溶液中氢氧根离子浓度,然后根据pH=-lgc(H+)计算出溶液的pH.
解答:
解:A.0.1 mol?L-1的CH3COOH溶液中氢离子浓度小于0.1mol/L,醋酸中氢氧根离子是水电离的,则由水电离的c(H+)大于10-13mol?L-1,故A错误;
B.pH=2的溶液中氢离子浓度为0.01mol/L,pH=1的CH3COOH溶液中氢离子浓度为0.1mol/L,则两溶液中c(H+)之比为:0.01mol/L:0.1mol/L=1:10,故B正确;
C.pH=12的NaOH溶液的浓度为0.01mol/L,pH=2的CH3COOH溶液中氢离子浓度为0.01mol/L,则醋酸的浓度大于0.01mol/L,两溶液等体积混合后醋酸过量,溶液显示酸性,则溶液的pH<7,故C正确;
D.1L 0.1 mol?L-1的Ba(OH)2溶液稀释为2L后,稀释后溶液中氢氧根离子浓度为:
=0.1mol/L,则稀释后溶液的pH=13,故D正确;
故选A.
B.pH=2的溶液中氢离子浓度为0.01mol/L,pH=1的CH3COOH溶液中氢离子浓度为0.1mol/L,则两溶液中c(H+)之比为:0.01mol/L:0.1mol/L=1:10,故B正确;
C.pH=12的NaOH溶液的浓度为0.01mol/L,pH=2的CH3COOH溶液中氢离子浓度为0.01mol/L,则醋酸的浓度大于0.01mol/L,两溶液等体积混合后醋酸过量,溶液显示酸性,则溶液的pH<7,故C正确;
D.1L 0.1 mol?L-1的Ba(OH)2溶液稀释为2L后,稀释后溶液中氢氧根离子浓度为:
| 0.1mol/L×2×1L |
| 2L |
故选A.
点评:本题考查了溶液酸碱性与溶液pH的计算、弱电解质的电离,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确溶液pH的表达式及计算方法,选项B为易错点,注意两溶液混合后醋酸过量.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
某基态原子的3d能级中有一个电子,其第四电子层中的电子数为( )
| A、0 | B、2 | C、3 | D、4 |
除去下列括号内杂质的试剂或方法错误的是( )
| A、N2(O2):通过灼热的镁粉 |
| B、SiO2(Fe2O3):足量的盐酸,过滤 |
| C、CO2(SO2):酸性KMnO4溶液、浓硫酸,洗气 |
| D、C2H5OH(CH3COOH):加足量CaO,蒸馏 |
下列物质中,可以作为食品防腐剂的是( )
| A、碳酸氢钠 | B、L-谷氨酸钠 |
| C、苯甲酸钠 | D、乳酸 |
某同学按如图所示的装置进行电解实验.下列说法正确的是( )


| A、电解过程中,铜电极上有H2产生 |
| B、电解过程中,铜电极不断溶解 |
| C、电解过程中,石墨电极上始终有铜析出 |
| D、整个电解过程中,H+的浓度不断增大 |
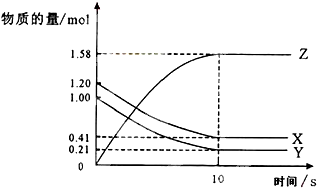 一定温度下,在2L的密闭容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示下列描述正确的是( )
一定温度下,在2L的密闭容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示下列描述正确的是( )| A、反应开始到10 s,用Z表示的反应速率为0.158 mol/(L?s) |
| B、反应开始到10 s,X的物质的量浓度减少了0.79 mol/L |
| C、反应开始到10 s时,Y的转化率为79% |
| D、反应的化学方程式为:X(g)+Y(g)?Z(g) |
下列物质中,含有自由移动的Cl-的是( )
| A、KClO3溶液 |
| B、CaCl2溶液 |
| C、KCl晶体 |
| D、液态HCl |
