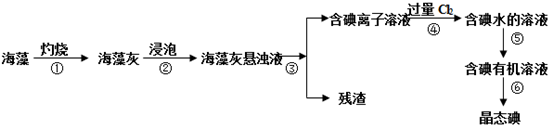
题目内容
四种短周期元素在周期表中的位置如图,其中Y元素被称为“国防金属”.下列说法不正确是( )
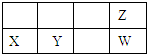

A、X离子结构示意图: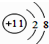 |
| B、原子半径Y比Z大 |
| C、元素的气态氢化物的稳定性Z强于W |
| D、X和Y两元素的最高价氧化物的对应水化物能相互反应 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:这几种元素都是短周期元素,根据元素在周期表中的位置知,Z属于第二周期元素,X、Y、W属于第三周期元素,Y元素被称为“国防金属”,则Y为Mg元素,根据它们之间关系知,X为Na元素、Z为C元素、W为Si元素,
A.X离子核外有2个电子层、最外层8个电子,核内有11个质子;
B.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
C.同一周期元素,元素的非金属性随着原子序数增大而减小,元素非金属性越强,其氢化物的稳定性越强;
D.X的最高价氧化物的水化物是NaOH,属于强碱,Y元素的最高价氧化物的水化物是Mg(OH)2,属于碱.
A.X离子核外有2个电子层、最外层8个电子,核内有11个质子;
B.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
C.同一周期元素,元素的非金属性随着原子序数增大而减小,元素非金属性越强,其氢化物的稳定性越强;
D.X的最高价氧化物的水化物是NaOH,属于强碱,Y元素的最高价氧化物的水化物是Mg(OH)2,属于碱.
解答:
解:这几种元素都是短周期元素,根据元素在周期表中的位置知,Z属于第二周期元素,X、Y、W属于第三周期元素,Y元素被称为“国防金属”,则Y为Mg元素,根据它们之间关系知,X为Na元素、Z为C元素、W为Si元素,
A.X离子核外有2个电子层、最外层8个电子,核内有11个质子,其离子结构示意图为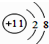 ,故A正确;
,故A正确;
B.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以Y原子半径大于W,W原子半径大于Z,则Y原子半径大于Z,故B正确;
C.非金属性Z>W,所以元素的气态氢化物的稳定性Z强于W,故C正确;
D.X的最高价氧化物的水化物是NaOH,属于强碱,Y元素的最高价氧化物的水化物是Mg(OH)2,属于碱,二者不反应,但氢氧化铝能溶于氢氧化钠溶液,故D错误;
故选D.
A.X离子核外有2个电子层、最外层8个电子,核内有11个质子,其离子结构示意图为
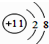 ,故A正确;
,故A正确;B.电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以Y原子半径大于W,W原子半径大于Z,则Y原子半径大于Z,故B正确;
C.非金属性Z>W,所以元素的气态氢化物的稳定性Z强于W,故C正确;
D.X的最高价氧化物的水化物是NaOH,属于强碱,Y元素的最高价氧化物的水化物是Mg(OH)2,属于碱,二者不反应,但氢氧化铝能溶于氢氧化钠溶液,故D错误;
故选D.
点评:本题考查了元素周期表和元素周期律的综合应用,涉及元素推断、物质结构、物质性质及元素周期律的应用等知识点,同时考查学生分析问题、灵活运用知识点解答问题能力,题目难度不大.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 |
| B、酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 |
| C、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| D、由单质A转化为单质B,△H=+119KJ/mol,可知单质A比单质B稳定 |
下列说法正确的( )
| A、Mg的摩尔质量是23克 |
| B、常温常压下,1molSO2的体积约为22.4L |
| C、标准状况下,9gH2O的体积约为11.2L |
| D、32g氧气中所含的氧气分子数为NA |
以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是( )
A、 腐蚀品 |
B、 爆炸品 |
C、 有毒气体 |
D、 易燃液体 |
下列有关氯水的叙述,正确的是( )
| A、新制氯水中只含有氯气和次氯酸分子 |
| B、新制氯水可使紫色石蕊试液先变红后褪色 |
| C、氯水光照时有气泡逸出,该气体的主要成分是氯气 |
| D、氯水放置数天后,其导电能力减弱 |
下列叙述中错误的是( )
| A、钠在空气中燃烧生成氧化钠 |
| B、钠是强还原剂 |
| C、钠在空气中燃烧生成过氧化钠 |
| D、钠燃烧发出黄色火焰 |
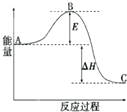 2SO2(g)+O2(g)=2SO3(g)△H=-198kJ?mol-1反应过程的能量变化如图所示.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)△H=-198kJ?mol-1反应过程的能量变化如图所示.请回答下列问题: