题目内容
下列说法正确的( )
| A、Mg的摩尔质量是23克 |
| B、常温常压下,1molSO2的体积约为22.4L |
| C、标准状况下,9gH2O的体积约为11.2L |
| D、32g氧气中所含的氧气分子数为NA |
考点:摩尔质量,气体摩尔体积,阿伏加德罗常数
专题:化学用语专题
分析:A、摩尔质量的单位错误;
B、常温常压下,气体摩尔体积不是22.4mol/L;
C、标况下,水是液态;
D、根据n=
来计算.
B、常温常压下,气体摩尔体积不是22.4mol/L;
C、标况下,水是液态;
D、根据n=
| m |
| M |
解答:
解:A、摩尔质量的单位是g/mol,故A错误;
B、常温常压下,气体摩尔体积不是22.4mol/L,故常温常压下,1molSO2的体积约不是22.4L,故B错误;
C、标况下,水是液态,故C错误;
D、32g氧气的物质的量n=
=
=1mol,则含有的氧气分子个数为NA,故D正确.
故选D.
B、常温常压下,气体摩尔体积不是22.4mol/L,故常温常压下,1molSO2的体积约不是22.4L,故B错误;
C、标况下,水是液态,故C错误;
D、32g氧气的物质的量n=
| m |
| M |
| 32g |
| 32g/mol |
故选D.
点评:本题考查了摩尔质量的单位以及相关计算,并考查了气体摩尔体积的相关计算,掌握公式的使用是关键.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
当2NO2(g)?N2O4(g)反应达平衡后,保持其它条件不变,压缩混合气体体积,所观察到的现象是( )
| A、红棕色先变浅后变深最终颜色较浅 |
| B、红棕色先变浅后变深最终颜色较深 |
| C、红棕色先变深后再变浅最终颜色较浅 |
| D、红棕色先变深后变浅最终颜色较深 |
四种短周期元素在周期表中的位置如图,其中Y元素被称为“国防金属”.下列说法不正确是( )
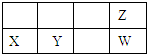

A、X离子结构示意图: |
| B、原子半径Y比Z大 |
| C、元素的气态氢化物的稳定性Z强于W |
| D、X和Y两元素的最高价氧化物的对应水化物能相互反应 |
甲烷和白磷均为正四面体结构,判断甲烷和白磷分子中化学键的键角关系( )
| A、前者小于后者 |
| B、前者大于后者 |
| C、二者相等 |
| D、无法判断 |
下列实验操作中,所用仪器合理的是( )
| A、用托盘天平称取25.20gNaCl |
| B、用四氯化碳萃取碘的饱和水溶液中的碘分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出. |
| C、在蒸发皿中放入NaCl溶液,加热、蒸发制取NaCl晶体 |
| D、用100mL容量瓶配制50mL0.1mol/L的盐酸 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、24g镁单质变为镁离子时,失去的电子数为2NA |
| B、18g水中所含原子总数为NA |
| C、22.4L甲烷中所含原子总数为5NA |
| D、H2SO4的摩尔质量为98g |
 下表是元素周期表的一部分,表中所列字母分别代表一种元素.
下表是元素周期表的一部分,表中所列字母分别代表一种元素.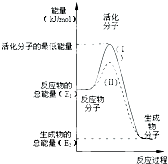 (1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图,然后回答问题.
(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图,然后回答问题.