题目内容
2.下列叙述正确的是( )| A. | C2H2分子内含有极性键,但C2H2分子是非极性分子 | |
| B. | 分子晶体、原子晶体一定含有共价键,离子晶体一定含有离子键 | |
| C. | 气态氢化物的稳定性随着其相对分子量的增大而增强 | |
| D. | 某非金属元素从游离态变成化合态时,该元素一定被还原 |
分析 A.C2H2为直线形分子,结构对称,正负电荷中心重叠;
B.单原子分子中没有共价键;
C.气态氢化物的稳定性与共价键的强弱有关;
D.根据元素的化合价变化判断.
解答 解:A.C2H2为直线形分子,结构对称,正负电荷中心重叠,分子不显电性,所以属于非极性分子,故A正确;
B.单原子分子中没有共价键,如稀有气体分子中没有共价键,所以分子晶体中不一定含有共价键,故B错误;
C.气态氢化物的稳定性与共价键的强弱有关,气态氢化物的稳定性与相对分子量无关,故C错误;
D.某非金属元素从游离态变成化合态时,该元素的化合价可能升高也可能降低,所以该元素可能被氧化,也可能被还原,故D错误.
故选A.
点评 本题考查了极性键、极性分子、化学键、氧化还原反应等知识点,难度不大,易错选项是B,注意稀有气体是单原子分子,只存在分子间作用力,不存在化学键.

练习册系列答案
相关题目
12.下列物质的沸点最高的是( )
| A. | 氯乙烷 | B. | 乙醇 | C. | 甲醛 | D. | 丁烷 |
13.卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子.以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁.
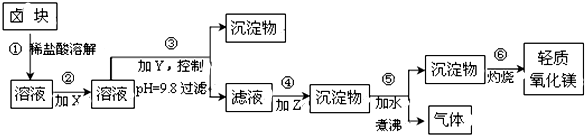
查阅资料得下表相关数据:
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽.
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的acd(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)步骤③控制pH=9.8的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、坩埚和泥三角.
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3•H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动.

查阅资料得下表相关数据:
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的acd(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)步骤③控制pH=9.8的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、坩埚和泥三角.
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3•H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动.
17.下列氢化物中稳定性最强的是( )
| A. | H2O | B. | NH3 | C. | H2S | D. | HF |
7.下列说法正确的是( )
| A. | CHCl3是三角锥形 | B. | AB2是V形,其A可能为sp2杂化 | ||
| C. | 二氧化硅是sp杂化,是非极性分子 | D. | NH4+是平面四边形结构 |
14.你认为下列说法正确的是( )
| A. | 氢键存在于分子之间,也存在于分子之内 | |
| B. | 对于分子,其范德华力只随着相对分子质量的增大而增大 | |
| C. | NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子 | |
| D. | 冰熔化时只破坏分子间作用力 |
11.某同学用5%的H2O2溶液做了一个探究实验,实验步骤如下:
步骤1:分别在2支大小相同的试管1和试管2中装入3.0mL5%的H2O2溶液.
步骤2:再分别往两支试管中滴入1~2滴1mol/L FeCl3溶液,
待试管中均有适量气泡出现时,将试管1放入盛有温度恒定为5℃冷水的烧杯中,试管2放入盛有温度恒定为40℃热水的烧杯中,同时用排水法收集产生的气体,并记录不同时刻(min)气体的总体积(mL),数据如下:
(1)向试管中加入的FeCl3溶液的作用起催化作用,写出加入FeCl3溶液后发生的化学反应方程式:2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑;
(2)相同时刻试管2中收集到的气体体积比试管1中多的原因是:2中温度高,由此该同学可以得出的实验结论是:温度越高反应速率越快;
(3)对比每分钟内收集到的气体体积变化,前5分钟内每分钟收集到的气体体积逐渐减小的原因是:H2O2的浓度随着反应的进行逐渐减小;
(4)若用单位时间内收集到的气体体积表示反应的快慢,则2min到5min试管2中生成气体的速率为:$\frac{81.3mL-41.2mL}{5min-2min}$=13.4mL/min.(请列出计算式并将计算结果保留3位有效数字)
步骤1:分别在2支大小相同的试管1和试管2中装入3.0mL5%的H2O2溶液.
步骤2:再分别往两支试管中滴入1~2滴1mol/L FeCl3溶液,
待试管中均有适量气泡出现时,将试管1放入盛有温度恒定为5℃冷水的烧杯中,试管2放入盛有温度恒定为40℃热水的烧杯中,同时用排水法收集产生的气体,并记录不同时刻(min)气体的总体积(mL),数据如下:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 试管1 | 17.5 | 34.9 | 50.1 | 60.3 | 70.4 | 80.2 | 84.9 | 85.2 | 85.4 |
| 试管2 | 21.7 | 41.2 | 57.5 | 70.8 | 81.3 | 84.9 | 85.3 | 85.4 | 85.4 |
(2)相同时刻试管2中收集到的气体体积比试管1中多的原因是:2中温度高,由此该同学可以得出的实验结论是:温度越高反应速率越快;
(3)对比每分钟内收集到的气体体积变化,前5分钟内每分钟收集到的气体体积逐渐减小的原因是:H2O2的浓度随着反应的进行逐渐减小;
(4)若用单位时间内收集到的气体体积表示反应的快慢,则2min到5min试管2中生成气体的速率为:$\frac{81.3mL-41.2mL}{5min-2min}$=13.4mL/min.(请列出计算式并将计算结果保留3位有效数字)
12.分子式为C4H8Cl2,只含二个甲基的不同结构的物质的数目(不考虑立体异构)为( )
| A. | 2种 | B. | 3种 | C. | 5种 | D. | 4种 |
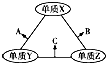 (Ⅰ) W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻; X,Y位于同一主族,它们能组成YX2,YX3两种常见化合物;W元素的氢化物与Z元素的氢化物反应生成盐.请回答下列问题:
(Ⅰ) W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻; X,Y位于同一主族,它们能组成YX2,YX3两种常见化合物;W元素的氢化物与Z元素的氢化物反应生成盐.请回答下列问题: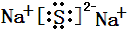 .(用元素符号表示)
.(用元素符号表示)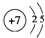 .
.