题目内容
20.室温下如图,关闭活塞,在左右两室(体积相同)各充入一定量H2和Cl2,且恰好使两容器内气体密度相同,打开活塞,点燃使H2与Cl2充分反应生成氯化氢气体:H2+Cl2=2HCl,恢复到原温度后,下列判断正确的是( )
| A. | 开始时左右两室分子数相同 | B. | 最终容器内无H2存在 | ||
| C. | 反应前后H2室压强相同 | D. | 最终容器内密度与原来相同 |
分析 根据密度=$\frac{m}{V}$知,相同体积时,密度之比等于其质量之比,要使其密度相同则两种气体质量相同,
A.N=nNA=$\frac{m}{M}{N}_{A}$,相同质量时,分子个数与摩尔质量成反比;
B.两种气体质量相同时,氢气的物质的多,氢气和氯气以1:1反应,则氢气过量;
C.反应前后氢气室气体的物质的量不同,温度相同导致压强不同;
D.反应前后气体总质量不变、容器体积不变,根据ρ=$\frac{m}{V}$计算密度.
解答 解:根据密度=$\frac{m}{V}$知,相同体积时,密度之比等于其质量之比,要使其密度相同则两种气体质量相同,
A.N=nNA=$\frac{m}{M}{N}_{A}$,相同质量时,分子个数与摩尔质量成反比,开始时两个容器气体质量相同,但物质的量不同,氢气物质的量多,则氢气室分子数多,故A错误;
B.两种气体质量相同时,氢气的物质的多,氢气和氯气以1:1反应,则氢气过量,所以最终容器内有氢气剩余,故B错误;
C.反应中氢气有剩余,则反应前后氢气室气体的物质的量不同,温度相同导致压强不同,故C错误;
D.反应前后气体总质量不变、容器体积不变,根据ρ=$\frac{m}{V}$知,最终容器内气体密度与原来相同,故D正确;
故选D.
点评 本题考查化学方程式的计算及物质的量计算,为高频考点,侧重考查学生分析计算能力,明确反应过程中哪些物理量变化、哪些物理量不变是解本题关键,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
16.实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列对测定结果评价错误的是( )
| 选项 | 操作 | 测定结果评价 |
| A | 酸式滴定管在装液前未用标准盐酸润洗2~3次 | 偏高 |
| B | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | 偏高 |
| C | 锥形瓶未干燥 | 无影响 |
| D | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 | 偏低 |
| A. | A | B. | B | C. | C | D. | D |
10.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A. | Y既可是金属也可是非金属 | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | X、Z形成的某化合物在熔融状态下不导电 | |
| D. | WY2分子中既有非极性键又有极性键 |

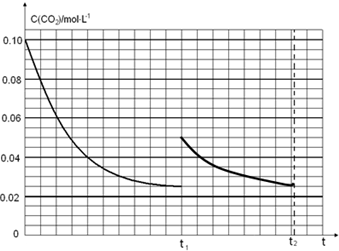 .
.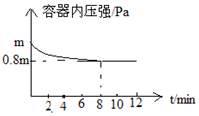 为氮及其化合物在工农业生产、生活中有着重要作用.在T℃时,将0.6mol H2和0.4mol N2置于容积2L的密闭容器中(压强为mPa)发生反应:N2(g)+3H2(g)?2NH3(g)△H<0 若保持温度不变,测得反应过程中容器内压强随时间变化如图所示:
为氮及其化合物在工农业生产、生活中有着重要作用.在T℃时,将0.6mol H2和0.4mol N2置于容积2L的密闭容器中(压强为mPa)发生反应:N2(g)+3H2(g)?2NH3(g)△H<0 若保持温度不变,测得反应过程中容器内压强随时间变化如图所示: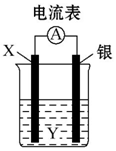 依据2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题:
依据2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题: