题目内容
16.实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列对测定结果评价错误的是( )| 选项 | 操作 | 测定结果评价 |
| A | 酸式滴定管在装液前未用标准盐酸润洗2~3次 | 偏高 |
| B | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | 偏高 |
| C | 锥形瓶未干燥 | 无影响 |
| D | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 | 偏低 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据中和滴定操作方法对c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$中V(标准)的影响判断滴定误差.
解答 解:A.酸式滴定管在装液前未用标准盐酸润洗2~3次,导致标准液被稀释,滴定时消耗标准液体积偏大,测定结果偏高,故A正确;
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失,导致消耗标准液体积偏大,测定结果偏高,故B正确;
C.锥形瓶未干燥,对待测液没有影响,则不影响测定结果,故C正确;
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次,导致待测液中溶质氢氧化钠的物质的量偏大,滴定时消耗标准液体积偏高,测定结果偏高,故D错误;
故选D.
点评 本题主要考查了中和滴定操作的误差分析,难度不大,明确中和滴定侧重方法为解答关键,根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$分析即可,试题培养了学生的化学实验能力.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
6.对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是( )
| A. | K+、Na+、Cl-、NO3- | B. | K+、NO3-、OH-、HCO3- | ||
| C. | Na+、Ca2+、Cl-、HCO3- | D. | SO42-、NH4+、S2-、Na+ |
7.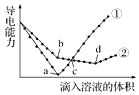 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | c点,两溶液中含有相同量的OH- | |
| B. | b点,溶液中大量存在的离子是Na+、OH- | |
| C. | ①代表滴加H2SO4溶液的变化曲线 | |
| D. | a、d两点对应的溶液均显中性 |
4.下列说法正确的是( )
| A. | 3C(s)+CaC(s)?CaC2 (s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| B. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 | |
| C. | 恒温恒压的密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)△H=-aKJ/mol,平衡时向容器中在充入一定量的NH3,重新达到平衡时a值不变 | |
| D. | C(s)+H2O(g)?CO(g)+H2(g) (△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 |
11.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
8.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 在加入铝粉能产生氢气的溶液中:Fe2+、K+、NO3-、Cl- | |
| B. | 澄清透明的溶液:Cu2+、SO42-、Mg2+、Cl- | |
| C. | 含有大量Al3+的溶液中:K+、Ba2+、AlO2-、Cl- | |
| D. | pH=1的溶液:Na+、ClO-、K+、CH3COO- |
20.室温下如图,关闭活塞,在左右两室(体积相同)各充入一定量H2和Cl2,且恰好使两容器内气体密度相同,打开活塞,点燃使H2与Cl2充分反应生成氯化氢气体:H2+Cl2=2HCl,恢复到原温度后,下列判断正确的是( )

| A. | 开始时左右两室分子数相同 | B. | 最终容器内无H2存在 | ||
| C. | 反应前后H2室压强相同 | D. | 最终容器内密度与原来相同 |