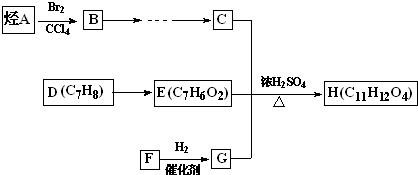
题目内容
手电筒中使用的干电池一般是普通锌锰干电池,在放电时总反应可表示为,Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3↑+H2O负极反应式: ;正极反应式: .
考点:原电池和电解池的工作原理
专题:电化学专题
分析:在放电时总反应可表示为,Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3↑+H2O,反应中Zn被氧化,应为原电池负极反应,Mn被还原,应为原电池正极反应,以此解答该题.
解答:
解:锌锰干电池放电时总反应式可表示为:Zn+2MnO2+2NH4+═Zn2++Mn2O3(S)+2NH3+H2O,Zn失电子做负极,则负极的电极反应为:Zn-2e-=Zn2+;正极材料为MnO2,发生还原反应,电极反应式为2MnO2+2NH4++2e-═Mn2O3+2NH3+H2O,
故答案为:Zn-2e-=Zn2+;2MnO2+2NH4++2e-═Mn2O3+2NH3+H2O.
故答案为:Zn-2e-=Zn2+;2MnO2+2NH4++2e-═Mn2O3+2NH3+H2O.
点评:本题考查原电池的组成和工作原理,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本题注意电极的组成和电极反应式以及总反应式的书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在0.04mol?L-1H2SO4溶液中,由水电离出的氢离子浓度是( )
| A、1.25×10-13mol?L-1 |
| B、0.02mol?L-1 |
| C、1×10-7mol?L-1 |
| D、1×10-12mol?L-1 |
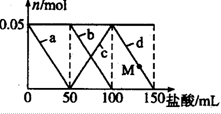 向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )| A、a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)2↓ |
| B、b和c曲线表示的离子反应是相同的 |
| C、原混合溶液中CO32-与Al2-的物质的量之比为1:1 |
| D、M点时,溶液中沉淀的质量为3.9g |
已知几种阴离子还原性强弱顺序为OH-<Cl-<Br-<I-<S2-,若某溶液含有相同浓度的OH-、Cl-、Br-、I-、S2-,当向其中逐滴滴入新制的饱和氯水直至过量时,最后被氧化的离子是( )
| A、Br- |
| B、Cl- |
| C、OH- |
| D、S2- |
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)?3C(g),若反应开始时充入2mol A和1.5molC,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数仍为a%的是( )
| A、2 mol C |
| B、1 mol B和1 mol C |
| C、2 mol A、1 mol B |
| D、3 mol A、0.5 mol B |