题目内容
按要求完成下列填空
(1)电负性最大的元素符号 ;第一电离能最大的元素基态原子核外电子排布式 ;第三周期原子半径最小的元素的价电子排布式 .
(2)在下列物质中:①N2、②H2O、③NaOH、④MgCl2、⑤C2H4、⑥Na2O2(用序号填空)其中只含有非极性键的是 ;既含有非极性键又含有极性键的是 ;含有非极性键的离子化合物是 .
(3)N≡N的键能为942kJ?mol-1,N-N单键的键能为247kJ?mol-1,通过计算说明N2中的 键更稳定(填“σ”或“π”).
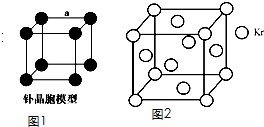
(4)钋(Po)是一种放射性金属,其晶胞的堆积模型如图1,钋的摩尔质量为209g?mol-1,晶胞的密度为ρ g?cm-3,则它晶胞的边长(a)为 cm.(用代数式表示,NA表示阿伏加德罗常数)
(5)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr.已知Kr晶体的晶胞结构如图2所示,该晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则
= .
(1)电负性最大的元素符号
(2)在下列物质中:①N2、②H2O、③NaOH、④MgCl2、⑤C2H4、⑥Na2O2(用序号填空)其中只含有非极性键的是
(3)N≡N的键能为942kJ?mol-1,N-N单键的键能为247kJ?mol-1,通过计算说明N2中的
(4)钋(Po)是一种放射性金属,其晶胞的堆积模型如图1,钋的摩尔质量为209g?mol-1,晶胞的密度为ρ g?cm-3,则它晶胞的边长(a)为
(5)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr.已知Kr晶体的晶胞结构如图2所示,该晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则
| m |
| n |

考点:晶胞的计算,原子核外电子排布,化学键
专题:
分析:(1)根据非金属性越强电负性越强来判断;元素的第一电离能是指气态原子失去1个电子形成气态阳离子克服原子核的引力而消耗的能量,原子越稳定其第一电离能越大;同周期从左到右原子半径依次减小;
(2)活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答;
(3)N≡N中含有2个π键,1个σ键,根据已知数据计算判断;
(4)根据晶胞中原子数目计算结合摩尔质量,计算晶胞质量,再根据密度定义计算晶胞的体积,求边长;
(5)以顶点为计算,与之相邻的最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×
+6×
=4,然后求出比值.
(2)活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答;
(3)N≡N中含有2个π键,1个σ键,根据已知数据计算判断;
(4)根据晶胞中原子数目计算结合摩尔质量,计算晶胞质量,再根据密度定义计算晶胞的体积,求边长;
(5)以顶点为计算,与之相邻的最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×
| 1 |
| 8 |
| 1 |
| 2 |
解答:
解:(1)根据非金属性越强电负性越强,周期表中非金属性最强的为F,所以F的电负性最大;元素的第一电离能是指气态原子失去1个电子形成气态阳离子克服原子核的引力而消耗的能量,原子越稳定其第一电离能越大,He为稀有气体中原子半径最小的,最难失去1个电子,所以He的第一电离能最大,He的电子排布式为1s2;同周期从左到右原子半径依次减小,所以第三周期原子半径最小的元素为Cl,其价电子排布式为3s23p5;
故答案为:F;1s2;3s23p5;
(2)只含有非极性键的是N2;既含有非极性键又含有极性键的是C2H4;含有非极性键的离子化合物是Na2O2;
故答案为:①;⑤;⑥;
(3)2)N≡N中含有2个π键,1个σ键,已知N≡N键能为942kJ/mol,N-N单键键能为247kJ/mol,则1个π键的键能为
kJ/mol=347.5kJ/mol,则N2中的π键键能大于σ键键能,较稳定,
故答案为:π;
(4)晶胞的堆积棋型为简单立方堆积,则晶胞中含有1个原子,故晶胞质量为
g,晶胞的体积为V=a3cm3,故晶胞密度ρ=
=
,解得a=
cm,故答案为:
;
(3)与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×
+6×
=4,则
=
=3,故答案为:3.
故答案为:F;1s2;3s23p5;
(2)只含有非极性键的是N2;既含有非极性键又含有极性键的是C2H4;含有非极性键的离子化合物是Na2O2;
故答案为:①;⑤;⑥;
(3)2)N≡N中含有2个π键,1个σ键,已知N≡N键能为942kJ/mol,N-N单键键能为247kJ/mol,则1个π键的键能为
| 942-247 |
| 2 |
故答案为:π;
(4)晶胞的堆积棋型为简单立方堆积,则晶胞中含有1个原子,故晶胞质量为
| 209 |
| NA |
| m |
| V |
| ||
| a3cm3 |
| 3 |
| ||
| 3 |
| ||
(3)与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| n |
| 12 |
| 4 |
点评:本题考查了电负性、化学键的稳定性判断以及晶胞的计算等知识点,注意根据均摊法计算晶胞中原子数目,计算晶胞的棱长是计算的关键.

练习册系列答案
相关题目
下列物质属于非电解质的是( )
| A、盐酸 |
| B、H2SO4 |
| C、酒精 |
| D、Cl2 |
将NaHSO4溶液和NaHCO3溶液混合,发生反应的离子方程式为( )
| A、H++HCO3-═H2O+CO2↑ |
| B、2HSO4-+CO32-═H2O+CO2↑+2SO42- |
| C、HSO4-+HCO3-═H2O+CO2↑+SO42- |
| D、2H++CO32-═H2O+CO2↑ |
用硫酸酸化的三氧化铬(CrO3)遇酒精后,其颜色由红变为蓝绿色,用这种现象可测得司机是否是酒后驾车.反应如下:2CrO3+3C2H5OH+3H2SO4=Cr2(SO4)3+3CH3CHO+6H2O此反应的还原剂是( )
| A、H2SO4 |
| B、CrO3 |
| C、Cr2(SO4)3 |
| D、C2H50H |
20g密度为dg/cm3的硝酸钙溶液中,含有1gCa2+离子,则NO3-离子的物质的量浓度为( )
A、
| ||
B、
| ||
| C、2.5dmol/L | ||
| D、1.25dmol/L |
将agNa2O2 溶于93.8g水中,完全反应后溶液为100g,则该溶液的溶质质量分数为( )
| A、4% | B、4.2% |
| C、8% | D、12% |
下列各组物质间的反应既属于氧化还原反应,又属于离子反应的是( )
| A、Zn与稀H2SO4 |
| B、NaCl溶液与AgNO3溶液 |
| C、H2与O2 |
| D、Na2O与H2O |
将2.3g Na放入100mL浓度为0.1mol?L-1的盐酸中,充分反应后共生成标准状况下H2的体积为( )
| A、0.112L |
| B、1.12L |
| C、0.224L |
| D、2.24L |