题目内容
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子、C原子的L能层中,都有两个未成对的电子,C、D同主族. E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
(1)基态D原子中具有不同运动状态的电子数目为 ;
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 ;
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 ;
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 ;
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为 .
(1)基态D原子中具有不同运动状态的电子数目为
(2)E2+离子的价层电子排布图是
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为
考点:位置结构性质的相互关系应用
专题:
分析:A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;C、D同主族,则D为S元素;E、F都是第四周期元素,E原子核外有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素,据此答题.
解答:
解::A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;C、D同主族,则D为S元素;E、F都是第四周期元素,E原子核外有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素,
(1)D为硫元素,S原子中有16个电子,也就具有16种不同运动状态,故答案为:16;
(2)E为铁元素,Fe2+离子的价层电子排布3d6,其价层电子排布图是 ,F为Cu元素,原子核外有29个电子,原子的电子排布式是1s22s22p63s23p63d104s1,
,F为Cu元素,原子核外有29个电子,原子的电子排布式是1s22s22p63s23p63d104s1,
故答案为: ;1s22s22p63s23p63d104s1;
;1s22s22p63s23p63d104s1;
(3)A元素的最高价氧化物对应的水化物为碳酸,中心原子碳原子的价层电子对数为
=3,所以碳原子的轨道杂化方式为sp2杂化;B的气态氢化物为NH3,NH3分子中N原子价层电子对数=
=4,其VSEPR模型为正四面体,
故答案为:sp2;四面体;
(4)化合物CO2、N2O和阴离子SCN-互为等电子体,根据互为等电子体构相似,可知SCN-的电子式与二氧化碳相似,为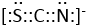 ,
,
故答案为: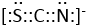 ;
;
(5)配合物甲的焰色反应呈紫色,可知其中含有 K元素,其内界由中心离子Fe3+与配位体CN-构成,配位数为6,甲为K3[Fe(CN)6],甲的水溶液可以用于实验室中Fe2+离子的定性检验,检验Fe2+离子的离子方程式为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,
故答案为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
(1)D为硫元素,S原子中有16个电子,也就具有16种不同运动状态,故答案为:16;
(2)E为铁元素,Fe2+离子的价层电子排布3d6,其价层电子排布图是
 ,F为Cu元素,原子核外有29个电子,原子的电子排布式是1s22s22p63s23p63d104s1,
,F为Cu元素,原子核外有29个电子,原子的电子排布式是1s22s22p63s23p63d104s1,故答案为:
 ;1s22s22p63s23p63d104s1;
;1s22s22p63s23p63d104s1;(3)A元素的最高价氧化物对应的水化物为碳酸,中心原子碳原子的价层电子对数为
| 4+2 |
| 2 |
| 5+3 |
| 2 |
故答案为:sp2;四面体;
(4)化合物CO2、N2O和阴离子SCN-互为等电子体,根据互为等电子体构相似,可知SCN-的电子式与二氧化碳相似,为
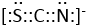 ,
,故答案为:
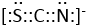 ;
;(5)配合物甲的焰色反应呈紫色,可知其中含有 K元素,其内界由中心离子Fe3+与配位体CN-构成,配位数为6,甲为K3[Fe(CN)6],甲的水溶液可以用于实验室中Fe2+离子的定性检验,检验Fe2+离子的离子方程式为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,
故答案为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
点评:本题主要考查了电子排布图、电子排布式、电子式、离子反应等化学用语,难度不大,解题的关键在于元素的推断,易错点为第(5)小问,Fe2+的检验方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列烷烃化学性质中不正确是( )
| A、不能使溴水因反应褪色 |
| B、能使酸性KMnO4溶液褪色 |
| C、与Cl2发生取代反应 |
| D、可以在空气中燃烧 |
0.01mol氯化铬(CrCl3?6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀则此配合物可能是( )
| A、[Cr(H2O)6]Cl3 |
| B、[Cr(H2O)5Cl]Cl2 |
| C、[Cr(H2O)4Cl2]Cl |
| D、[Cr(H2O)3Cl3] |
在汽车加油站见到的油罐车上,所贴有的危险化学品标志是( )
A、 |
B、 |
C、 |
D、 |
下列各组中的离子,能在溶液中大量共存的是( )
| A、Na+、H+、SO42-、OH- |
| B、K+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、K+、Cu2+、Cl-、SO42- |
下列说法中正确的是( )
| A、难溶电解质的Ksp越小,溶解度就一定越小 |
| B、一般认为沉淀离子浓度小于1.0×10-5 mol/L时,沉淀就达完全 |
| C、用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) |
| D、向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 |
下列物质中不能用作漂白剂的是( )
| A、SO2 |
| B、Ca(ClO)2 |
| C、浓硫酸 |
| D、Na2O2 |